题目内容
9.已知:①2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol;
②H2(g)+S(g)═H2S(g)△H=-20.1kJ/mol.
下列判断一定正确的是( )
| A. | 由①知,氢气的燃烧热为241.8 kJ | |
| B. | 由①、②知,2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-443.4kJ/mol | |
| C. |  反应②中的能量变化可用如图表示 | |
| D. | 若反应②中改用固态硫,则放热大于20.1 kJ |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B.根据盖斯定律计算2H2S(g)+O2(g)=2S(g)+2H2O(g)的反应热;
C.反应②为放热反应,生成物的总能量小于反应物的总能量;
D.固体变为气体,吸收热量;
解答 解:A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,氢气燃烧的稳定氧化物为液态水,故A错误;
B.已知:①2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
②H2(g)+S(g)=H2S(g)△H=-20.1kJ/mol,
由盖斯定律:①-②得2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-443.4 kJ/mol,故B正确;
C.反应②为放热反应,生成物的总能量小于反应物的总能量,故C错误;
D.固体变为气体,吸收热量,则若反应②中改用固态硫,1molS(s)完全反应,放出的热量小于20.1kJ,故D错误.
故选B.
点评 本题考查反应热与焓变,侧重于基本概念的理解,有利于培养学生的良好的科学素养,难度不大,注意把握化学反应与能量变化的理解.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
19.萜品醇可作为消毒剂、抗氧化剂和溶剂.已知α-萜品醇的结构简式如下式,则下列说法错误的是( )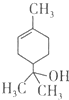

| A. | 1mol该物质最多能和lmol氢气发生加成反应 | |
| B. | 该物质属于烃 | |
| C. | 该物质能使溴水褪色 | |
| D. | 分子式为C9H16O |
20.下列分析正确的是( )
| A. | Na、Al、Fe、Cu在空气中都易生锈是因为都生成了对应的氧化物 | |
| B. | 在高温下用氢气还原MgCl2可制取金属镁 | |
| C. | 实验测得NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性CH3COOH>H2CO3 | |
| D. | 高温时,CuO比Cu2O稳定,Na2O2比Na2O稳定 |
14.下列实验事实与图象对应正确的是( )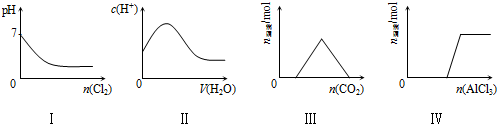

| A. | I表示向Na2SO3溶液中通入Cl2 | |
| B. | II表示向纯CH3COOH中逐滴加水并不断振荡 | |
| C. | III表示向KOH和Ca(OH)2混合液中通入CO2 | |
| D. | Ⅳ表示向NaOH溶液中逐滴加入AlCl3溶液并不断振荡 |
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标况下,22.4L SO3含有3NA个O原子 | |
| B. | 常温常压下,27g Al与足量NaOH 溶液反应生成1.5NA个H2 | |
| C. | 常温常压下,32g氧气与臭氧(O3 )的混合物中含有NA个氧原子 | |
| D. | 物质的量浓度为1 mol•L-1 的 K2SO4 溶液中,含2NA个K+ |
18.下列各组离子能大量共存的是( )
| A. | Fe3+、Mg2+、I-、SO42- | B. | NH4+、Al3+、NO3-、Cl- | ||
| C. | H+、Na+、Ca2+、ClO- | D. | Ba2+、K+、OH-、CO32- |
13.下列应用或事实中,与胶体的制备或性质没有关系的是( )
| A. | 水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染 | |
| B. | 用石膏或盐卤点制豆腐 | |
| C. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| D. | 氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解 |