题目内容
8.写出下列反应的方程式:(1)氢氧化铜浊液中加入乙酸Cu(OH)2+2CH3COOH═(CH3COO)2Cu+2H2O;
(2)碳酸钠溶液中加入乙酸Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑;
(3)铜丝在酒精灯上灼烧迅速插入乙醇中2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(4)甲醇与乙酸发生酯化反应CH3COOH+CH3OH
 CH3COOCH3+H2O.
CH3COOCH3+H2O.
分析 (1)氢氧化铜浊液中加入乙酸,发生中和反应生成乙酸铜和水;
(2)碳酸钠溶液中加入醋酸,反应生成醋酸钠和二氧化碳、水;
(3)金属铜在反应中作催化剂,加热条件下与氧气反应生成乙醛与水;
(4)乙酸和甲醇在浓硫酸作用下加热发生酯化反应,酸脱羟基醇脱氢原子生成乙酸甲酯和水.
解答 解:(1)氢氧化铜浊液中加入乙酸发生中和反应,反应方程式为:Cu(OH)2+2CH3COOH═(CH3COO)2Cu+2H2O,
故答案为:Cu(OH)2+2CH3COOH═(CH3COO)2Cu+2H2O;
(2)碳酸钠溶液中加入醋酸,反应的方程式为:Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑,
故答案为:Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑;
(3)铜能被氧气氧化为黑色氧化铜,氧化铜能将乙醇氧化为乙醛,同时由黑色氧化铜又变成红色铜,金属铜在反应中作催化剂,整个过程的反应为:
2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,C2H5OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O,反应的总方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(4)乙酸和甲醇在浓硫酸作用下加热生成乙酸甲酯和水;反应的化学方程式为:CH3COOH+CH3OH CH3COOCH3+H2O;
CH3COOCH3+H2O;
故答案为:CH3COOH+CH3OH CH3COOCH3+H2O.
CH3COOCH3+H2O.
点评 本题考查了化学方程式的书写,侧重有机物的性质的考查,掌握有机物官能团的性质是解答的关键,题目难度不大.

练习册系列答案
相关题目
18.固体粉末X中可能含有K2SO3、K2CO3、FeO、Fe2O3、MnO2、Na2SO4、NaNO3中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下: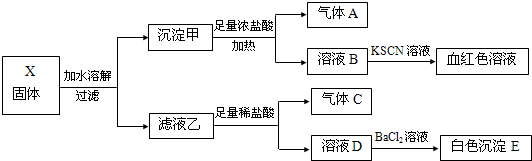
根据上述实验,下列说法正确的是( )

根据上述实验,下列说法正确的是( )
| A. | 固体X中一定含有Fe2O3 | |
| B. | 沉淀E可能含有BaSO3 | |
| C. | 气体A、C一定均为纯净物 | |
| D. | 固体X可能出现含有K2SO3、K2CO3而不含Na2SO4的情况 |
19.已知元素Se位于第四周期VIA族,下列说法不正确的是( )
| A. | 单质Se在空气中燃烧可生成SeO2 | B. | Se的原子序数为24 | ||
| C. | 可形成Na2SeO3、Na2SeO4两种盐 | D. | H2S比H2Se稳定 |
16.下列解释实验事实的方程式正确的是( )
| A. | CuSO4溶液中加入过量氨水得到深蓝色溶液:Cu2++2OH-═Cu(OH)2↓ | |
| B. | 碳酸钠溶液中滴入酚酞试液,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| C. | FeCl2溶液中加入K3[Fe(CN)6]溶液,生成蓝色沉淀:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ | |
| D. | 90℃时,测得纯水pH=6.7,pH<7的原因是:H2O(l)?H+(aq)+OH-(aq)△H<0 |
13.向3支盛有少量Mg(OH)2沉淀的试管中分别滴加适量的蒸馏水,盐酸和氯化铵溶液,观察并记录现象,并写出实验中有关反应的化学方程式.
| 滴加试剂 | 蒸馏水 | 盐酸 | 氯化铵溶液 |
| 现象 |

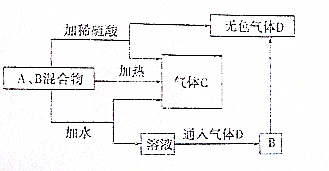 有A、B两种常见化合物,其焰色反应均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去)回答下列问题:
有A、B两种常见化合物,其焰色反应均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去)回答下列问题: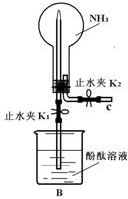 (1)甲同学用如图B装置做NH3喷泉实验,关闭K2,打开K1,用手捂热圆底烧瓶,一段时间后看到烧瓶内有红色喷泉现象.
(1)甲同学用如图B装置做NH3喷泉实验,关闭K2,打开K1,用手捂热圆底烧瓶,一段时间后看到烧瓶内有红色喷泉现象.