题目内容
11.下列有关溶液的说法正确的是( )| A. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 物质的量浓度相等的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl 溶液、④(NH4)2Fe(SO4)2溶液中,c(${NH}_{4}^{+}$)的大小关系:④>①>②>③ | |
| C. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1 NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>c(Na+)>c(A-) | |
| D. | 物质的量浓度之比为1:1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(${HCO}_{3}^{-}$)+c(${CO}_{3}^{2-}$) |
分析 A.由于(NH4)2SO4=2NH4++SO42-,溶液中NH4+浓度增大,一水合氨的电离程度减小;
B.(NH4)2SO4、(NH4)2Fe(SO4)2的化学式中含有2个铵根离子,且亚铁离子抑制了铵根离子的水解,则(NH4)2Fe(SO4)2溶液中铵根离子浓度最大,其次为(NH4)2SO4,碳酸氢根离子促进了铵根离子的水解,则四种溶液中,NH4HCO3溶液中铵根离子浓度最小;
C.反应后溶液中溶质为等浓度的HA和NaA,混合液pH大于7,说明A-的水解程度大于HA的电离程度,则c(HA)>c(A-),再结合物料守恒可得c(HA)>c(Na+)>c(A-);
D.根据次氯酸钠、碳酸氢钠溶液中的物料守恒判断.
解答 解:A.由于(NH4)2SO4=2NH4++SO42-导致溶液中NH4+浓度增大,抑制氨水的电离,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小,故A错误;
B.浓度相同的四种溶液中,(NH4)2SO4、(NH4)2Fe(SO4)2的化学式中含有2个铵根离子,且亚铁离子抑制了铵根离子的水解,则(NH4)2Fe(SO4)2溶液中c(NH4+)最大,其次为(NH4)2SO4,碳酸氢根离子促进了NH4+的水解,则四种溶液中,NH4HCO3溶液中c(NH4+)最小,所以c(NH4+)的大小关系为:④>①>③>②,故B错误;
C.将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合后,溶质为等浓度的HA和NaA,混合液pH大于7,说明A-的水解程度大于HA的电离程度,则c(HA)>c(A-),根据物料守恒c(A-)+c(HA)=2c(Na+)可知:c(HA)>c(Na+)>c(A-),故C正确;
D.物质的量浓度之比为1:1的NaClO、NaHCO3混合溶液中,根据物料守恒可得:c(HClO)+c(ClO-)=c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故D错误;
故选C.
点评 本题考查离子浓度大小比较、盐的水解原理及其应用等知识,题目难度中等,在判断能水解的盐溶液中离子浓度大小时,要注意把握影响盐类水解的外界条件,把握弱电解质的电离特征及其影响因素.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| A. | 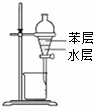 用图所示装置分离苯和水 | |
| B. | 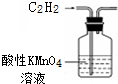 用图所示装置除去C2H2中含有的少量H2S | |
| C. | 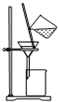 用图所示装置分离NaCl和CaCl2的混合溶液 | |
| D. | 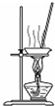 用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| A. | 单质Se在空气中燃烧可生成SeO2 | B. | Se的原子序数为24 | ||
| C. | 可形成Na2SeO3、Na2SeO4两种盐 | D. | H2S比H2Se稳定 |
| A. | 热稳定性:H2O>H2S>HF | |
| B. | 微粒X2-和Y2+的核外电子排布相同,离子半径:X2-<Y2+ | |
| C. | 第3周期金属都能与氯气发生化合反应 | |
| D. | 第IVA族元素的氧化物都能与NaOH溶液反应生成盐和水 |
| A. | CuSO4溶液中加入过量氨水得到深蓝色溶液:Cu2++2OH-═Cu(OH)2↓ | |
| B. | 碳酸钠溶液中滴入酚酞试液,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| C. | FeCl2溶液中加入K3[Fe(CN)6]溶液,生成蓝色沉淀:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ | |
| D. | 90℃时,测得纯水pH=6.7,pH<7的原因是:H2O(l)?H+(aq)+OH-(aq)△H<0 |
 .
.
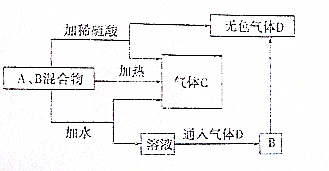 有A、B两种常见化合物,其焰色反应均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去)回答下列问题:
有A、B两种常见化合物,其焰色反应均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去)回答下列问题: 向Fe(OH)3胶体中滴入硫酸直到过量,描述此过程的实验现象_______________________。
向Fe(OH)3胶体中滴入硫酸直到过量,描述此过程的实验现象_______________________。