题目内容
【题目】锰元素的化合物在多个领域中均有重要应用。
(1)二价锰的3种离子化合物的熔点如表:
物质 | MnCl2 | MnS | MnO |
熔点 | 650℃ | 1610℃ | 2800℃ |
上表3种物质中晶格能最大的是___。
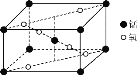
(2)某锰氧化物的晶胞结构如图所示,该氧化物的化学式为___。
(3)与NO3-互为等电子体的一种分子为___(填化学式)。
【答案】MnO MnO2 SO3或BF3
【解析】
(1)三种物质都是离子晶体,离子半径越小,离子键就越强,离子晶体的晶格能就越大,物质的熔点就越高,根据表格数据可知上表三种物质中晶格能最大的是MnO;
故答案为:MnO;
(2)由图可知,晶胞中Mn原子位于体心与顶点上,O原子位于上下两个面上及体内(有2个),故晶胞中Mn元素数目=1+8×1/8=2、O原子数目=2+4×1/2=4;所以该氧化物的化学式为MnO2;
故答案为:MnO2;
(3) 原子总数相同、价电子总数相同的微粒互为等电子体,与NO3-互为等电子体的一种分子为SO3或BF3;
故答案是:SO3或BF3。

练习册系列答案
相关题目