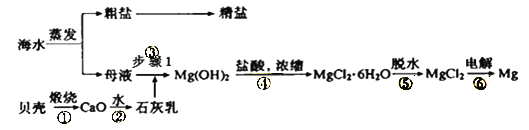
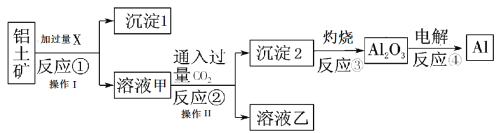
题目内容
【题目】25℃时,将浓度均为![]() 、体积分别为
、体积分别为![]() 和
和![]() 的
的![]() 溶液与
溶液与![]() 溶液按不同体积比混合,保持
溶液按不同体积比混合,保持![]() ,
,![]() 、
、![]() 与混合液的
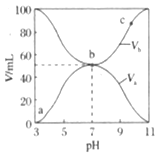
与混合液的![]() 的关系如图所示。下列说法正确的是( )
的关系如图所示。下列说法正确的是( )
A. ![]()
B. b点,![]()
C. a、b、c三点,c点时水电离出的![]() 最大
最大
D. ![]() 点过程中,可能存在
点过程中,可能存在![]()
【答案】B
【解析】
根据图象可知,当NH3·H2O的体积为0时,HX溶液的pH=3,0.1mol·L-1HX的pH=3,则说明HX为弱酸,然后利用“三个守恒”、影响盐类水解的因素进行分析;
A、根据图象可知,b点加入等体积等浓度的HX和NH3·H2O,两者恰好反应生成NH4X,此时溶液的pH=7,说明X-和NH4+水解程度相同,即Ka(HX)=Kb(NH3·H2O),故A错误;
B、根据A选项分析,b点溶质为NH4X,根据电荷守恒,有c(NH4+)+c(H+)=c(OH-)+c(X-),该点pH=7,c(OH-)=c(H+),得出c(NH4+)=c(X-),依据物料守恒,c(HX)+c(X-)=0.05mol·L-1,即c(NH4+)+c(HX)=0.05mol·L-1,故B正确;
C、b点是两种物质恰好完全反应,溶质为NH4X,NH4X属于弱酸弱碱盐,发生双水解,水的电离程度最大,即b点时水电离出的c(H+)最大,故C错误;
D、根据电荷守恒,c(NH4+)+c(H+)=c(OH-)+c(X-),a→b溶液显酸性,即c(H+)>c(OH-),则c(NH4+)<c(X-),故D错误;
答案选B。

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目