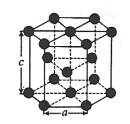
题目内容
【题目】硫酸铅( PbSO4) 广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为 PbS, 含有FeS2等杂质)和软锰矿(主要成分为MnO2 ) 制备PbSO4的工艺流程如图:

已知:
i. PbCl2难溶于冷水,易溶于热水
ii. PbCl2 (s) + 2 Cl- ( aq ) ![]() PbCl42-( aq ) △H> 0
PbCl42-( aq ) △H> 0
iii.Ksp(PbSO4) =1. 08 ×10-8 , Ksp(PbC12) = 1. 6× 10 -5
(1)“浸取”过程中盐酸与MnO2 、P bS 发生反应生成PbCl2和S 的化学方程式为______________,加入NaCl 的目的是__________________。
(2)沉降操作时加入冰水的作用是_______________________。
(3) 20°C 时 ,PbCl2 ( s) 在不同浓度盐酸中的最大溶解量( g L-1 ) 如图所示。下列叙述正确的是_____________(填字母)

A. 盐酸浓度越小,Ksp(PbC12)越小
B.x、y 两点对应的溶液中c( Pb2+ )不相等
C 当盐酸浓度为1 mol L-1 时,溶液中c( Pb2+)一定最小
D. 当盐酸浓度小于1 mol L-1时 ,随 HCl 浓度增大,P bCl2 溶解量减少是因为 Cl-浓度增大使 PbCl2溶解平衡逆向移动
(4)调 pH 的目的是__________,PbC12 “转化”后得到 PbSO4, 当c (Cl-)= 0.100mol/L 时 ,c( SO42-) =________________。
(5)滤液 a 经过处理后可以返回到______工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂--三盐基硫酸 (3 PbOPbSO4H2O) ,写出该反应的化学方程式 _____________________.
【答案】MnO2 + PbS +4HCl =PbCl2+ S + MnCl2+ 2H2O 增大c( Cl- ) 浓度,平衡ii 向右移动, 增大PbCl2溶解性(或将难溶的PbCl2 转化为 PbCl42-溶入水中,增大PbCl2 溶解性) PbCl2 难溶于冷水,降低PbCl2的 溶解度,便于PbCl2 析出晶体 BD 使 Fe3+ 沉淀而除去 6. 75 × 10-6 浸取 4PbSO4+ 6 NaOH=3 PbO PbSO4H2O + 3Na2SO4 +2 H2O
【解析】
方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)中加入稀盐酸,盐酸与MnO2、PbS发生反应生成PbCl2和S,MnO2被还原成Mn2+,加入的NaCl可促进反应PbCl2(s)+2Cl-(aq)PbCl42-(aq)平衡正向移动使更多的Pb元素存在于溶液中;加入Fe2O3溶液调节溶液pH,使铁离子转化成氢氧化铁沉淀除去,然后过滤;PbCl2难溶于冷水,将滤液冷水沉降过滤得到PbCl2晶体,之后加入稀硫酸发生沉淀转化,生成硫酸铅晶体,过滤得到晶体烘干得到硫酸铅粉末,滤液a中主要成分为HCl。
(1)根据题意可知该过程中MnO2将PbS2中的S元素氧化成S单质,锰元素被还原成Mn2+,根据电子守恒和元素守恒可得方程式为MnO2+PbS+4HCl![]() PbCl2+S+MnCl2 +2H2O;加入NaCl 的目的是增大c( Cl- ) 浓度,平衡ii 向右移动, 增大PbCl2溶解性(或将难溶的PbCl2 转化为 PbCl42-溶入水中,增大PbCl2 溶解性);
PbCl2+S+MnCl2 +2H2O;加入NaCl 的目的是增大c( Cl- ) 浓度,平衡ii 向右移动, 增大PbCl2溶解性(或将难溶的PbCl2 转化为 PbCl42-溶入水中,增大PbCl2 溶解性);
(2)温度降低,PbC12+2C1-![]() PbC142-平衡左移,使PbC142-转化为PbC12,便于析出PbC12晶体(或PbC12难溶于冷水,降低PbC12的溶解度,便于析出PbC12晶体),所以沉降时加入冰水;
PbC142-平衡左移,使PbC142-转化为PbC12,便于析出PbC12晶体(或PbC12难溶于冷水,降低PbC12的溶解度,便于析出PbC12晶体),所以沉降时加入冰水;
(3)PbCl2是微溶化合物,溶于水存在平衡:PbCl2(s)![]() Pb2+(aq)+2Cl-(aq),由图象可知在浓度为1mol/L时溶解量最小;结合题目所给信息可知,小于1mol/L时,主要是电离出的氯离子抑制氯化铅的溶解,大于1mol/L时,可发生PbCl2(s)+2Cl-(aq)
Pb2+(aq)+2Cl-(aq),由图象可知在浓度为1mol/L时溶解量最小;结合题目所给信息可知,小于1mol/L时,主要是电离出的氯离子抑制氯化铅的溶解,大于1mol/L时,可发生PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq),而促进溶解。
PbCl42-(aq),而促进溶解。
A.Ksp(PbCl2)只受温度的影响,温度不变,则Ksp(PbCl2)不变,故A错误;
B.根据分析可知x、y两点对应的溶液中的溶质不同,所以c(Pb2+)不相等,故B正确;
C.根据分析可知当盐酸浓度大于1mol/L之后,主要发生反应:PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq),所以此时c(Pb2+)不一定最小,故C错误;
PbCl42-(aq),所以此时c(Pb2+)不一定最小,故C错误;
D.根据分析可知盐酸浓度小于1mol·L-1时,主要存在平衡PbCl2(s)![]() Pb2+(aq)+2Cl-(aq),氯离子的增多使平衡逆向移动,故D正确;
Pb2+(aq)+2Cl-(aq),氯离子的增多使平衡逆向移动,故D正确;
综上所述选BD;
(4)调节pH的主要目的是使Fe3+转化为沉淀,从而除去;
沉淀转化的方程式为PbCl2(s)+SO42-(aq)PbSO4(s)+2Cl-(aq),该反应的平衡常数K=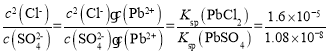 ,所以当c(Cl-)=0.1mol/L时,c(SO42-)=
,所以当c(Cl-)=0.1mol/L时,c(SO42-)= 6.75×10-6mol/L;
6.75×10-6mol/L;
(5)发生沉淀转化后,滤液a中的主要溶质为HCl,所以经处理后可以返回到浸取工序循环使用;反应物有PbSO4和NaOH,生成中有3PbO·PbSO4·H2O ,根据元素化合价的变化可知该反应不是氧化还原反应,根据元素守恒可得方程式:4PbSO4+6NaOH=3PbO·PbSO4·H2O+3Na2SO4+2H2O。

 阅读快车系列答案
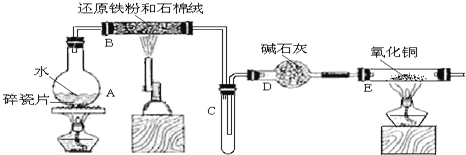
阅读快车系列答案【题目】为探究Na与CO2反应的产物,某化学兴趣小组按如图所示装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3
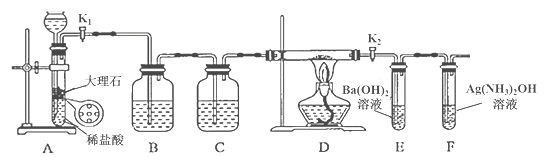
回答下列问题:
(1)B中的溶液为______________。
(2)先称量硬质玻璃管的质量为ml g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g。再进行下列实验操作,其正确顺序是____________(填标号);重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊 e.关闭K1和K2 f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________________________;
(4)探究固体产物中钠元素的存在形式
假设一:只有Na2CO3; 假设二:只有Na2O; 假设三:Na2O和Na2CO3均有;
完成下列实验设计,验证上述假设:
步骤 | 操作和现象 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
(5)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式_____________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |
【题目】锰元素的化合物在多个领域中均有重要应用。
(1)二价锰的3种离子化合物的熔点如表:
物质 | MnCl2 | MnS | MnO |
熔点 | 650℃ | 1610℃ | 2800℃ |
上表3种物质中晶格能最大的是___。
(2)某锰氧化物的晶胞结构如图所示,该氧化物的化学式为___。
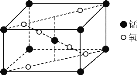
(3)与NO3-互为等电子体的一种分子为___(填化学式)。
【题目】有A、B、C、D、E五种元素。其相关信息如下:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C的基态原子2p轨道中有三个未成对电子 |
D | D是主族元素且与E同周期,其最外能层上有两个运动状态不同的电子 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式_______。
(2)C元素的第一电离能比氧元素的第一电离能_____(填“大”或“小”)。
(3)CA3分子中C原子的杂化轨道类型是______,CA3分子的空间构型是_____。
(5)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有________(填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(5)B与D可形成离子化合物,其晶胞结构如图所示。其中D离子的配位数为_______。