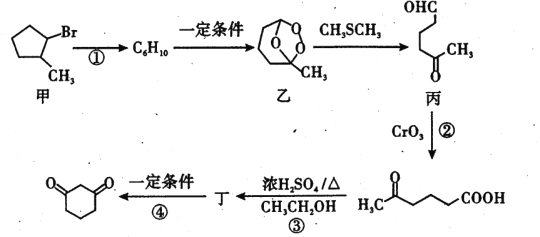
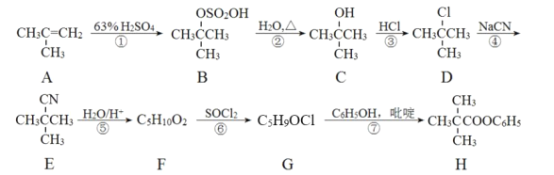
题目内容
【题目】钼酸钠晶体(Na2MoO42H2O)是一种金属腐蚀抑制剂。如图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。
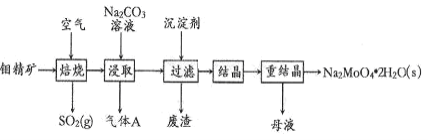
(1) Na2MoO42H2O中钼元素的化合价是_____;在焙烧炉中,空气从炉底进入,矿石经粉碎后从炉顶进入,这样处理的目的是_____
(2)“焙烧”时MoS2转化为MoO3,写出该反应的化学方程式:_____,反应中氧化产物是_____(填化学式)。
(3)“浸取”时含钼化合物发生反应的离子方程式为___________;“结晶”前需向滤液中加入Ba(OH)2固体以除去CO32-。若滤液中c(MoO42-)= 0.40 mol L-1,c(CO32-)= 0.10 molL-1,当BaMoO4开始沉淀时,CO32-的去除率是_____% [已知:Ksp(BaCO3)=1×10-9,Ksp(BaMoO4)=4.0×l0-8]。
(4)“分析纯”的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与流程中所产生的气体一起通入水中,得到正盐的化学式为_____。
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_____
②碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是_____。
【答案】+6 增大固气接触面积,加快反应速率,提高原料利用率 2MoS2+7O2![]() 2MoO3+4SO2 MoO3、SO2 MoO3+CO32-=MoO42-+CO2↑ 90% (NH4)2CO3、(NH4)2SO3 1:1 酸浓度较低时,Cl-对碳钢的腐蚀作用大于SO42-,使碳钢在盐酸中的腐蚀速率明显快于硫酸,随着酸浓度增大,硫酸会使钢铁钝化,腐蚀速率减慢
2MoO3+4SO2 MoO3、SO2 MoO3+CO32-=MoO42-+CO2↑ 90% (NH4)2CO3、(NH4)2SO3 1:1 酸浓度较低时,Cl-对碳钢的腐蚀作用大于SO42-,使碳钢在盐酸中的腐蚀速率明显快于硫酸,随着酸浓度增大,硫酸会使钢铁钝化,腐蚀速率减慢
【解析】
“焙烧”:氧气将MoS2、PbS氧化成MoO3、PbO、SO2;“浸取”:主要反应为MoO3和Na2CO3溶液反应生成Na2MoO4和CO2;“过滤”:Ba(OH)2将过量的CO32-转化为BaCO3沉淀,通过“过滤”将BaCO3、PbO除去;“结晶”:通过蒸发浓缩、冷却结晶、过滤得到粗Na2MoO42H2O固体;通过“重结晶”得Na2MoO42H2O,据此解答。
(1)根据化合物中元素化合价代数和为0可知Na2MoO42H2O中钼元素的化合价为+6价,矿石经粉碎及从炉顶进入可增大固气接触面积,加快反应速率,同时使原料中的MoS2尽可能反应,提高原料利用率,故答案为:+6;增大固气接触面积,加快反应速率,提高原料利用率;
(2)“焙烧”:氧气将MoS2氧化成MoO3、SO2,反应的方程式为:2MoS2+7O2![]() 2MoO3+4SO2,氧化产物为MoO3、SO2,故答案为:2MoS2+7O2
2MoO3+4SO2,氧化产物为MoO3、SO2,故答案为:2MoS2+7O2![]() 2MoO3+4SO2;MoO3、SO2;
2MoO3+4SO2;MoO3、SO2;
(3)“浸取”:主要反应为MoO3和Na2CO3溶液反应生成Na2MoO4和CO2,反应的离子方程式为:MoO3+CO32-=MoO42-+CO2↑。Ksp(BaMoO4)=4.0×10-8,c(MoO42-)=0.40 mol L-1,由Ksp(BaMoO4=![]() 得:当BaMoO4开始沉淀时,c(Ba2+)=
得:当BaMoO4开始沉淀时,c(Ba2+)=![]() =10-7mol/L,由Ksp(BaCO3)=
=10-7mol/L,由Ksp(BaCO3)=![]() 得,此时溶液中c(CO32-)=
得,此时溶液中c(CO32-)=![]() =10-2mol/L,所以,CO32-的去除率=
=10-2mol/L,所以,CO32-的去除率=![]() ,故答案为:MoO3+CO32-=MoO42-+CO2↑;90%;
,故答案为:MoO3+CO32-=MoO42-+CO2↑;90%;
(4)(NH4)2MoO4和NaOH反应生成Na2MoO4、H2O和NH3,流程中产生的气体为SO2、CO2,SO2、NH3、CO2通入水中可产生(NH4)2CO3、(NH4)2SO3两种正盐,故答案为:(NH4)2CO3、(NH4)2SO3;
(5)①由图可知,碳素钢的缓蚀效果最优时,钼酸钠和月桂酰肌氨酸的浓度都为150mg/L,即二者浓度比为1:1,故答案为:1:1;
②从图上看,相同浓度的盐酸比相同浓度的硫酸腐蚀碳钢的速率大的多,一方面,二者的阴离子不同,可能是酸浓度较低时,Cl-对碳钢的腐蚀作用大于SO42-,使碳钢在盐酸中的腐蚀速率明显快于硫酸,另一方面,随着酸浓度增大,浓硫酸会使钢铁钝化,腐蚀速率减慢,故答案为:酸浓度较低时,

 活力课时同步练习册系列答案
活力课时同步练习册系列答案【题目】锰元素的化合物在多个领域中均有重要应用。
(1)二价锰的3种离子化合物的熔点如表:
物质 | MnCl2 | MnS | MnO |
熔点 | 650℃ | 1610℃ | 2800℃ |
上表3种物质中晶格能最大的是___。
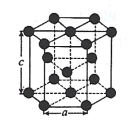
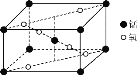
(2)某锰氧化物的晶胞结构如图所示,该氧化物的化学式为___。
(3)与NO3-互为等电子体的一种分子为___(填化学式)。