题目内容
【题目】氢能源是公认的零碳消洁能源,用乙醇为原料可通过多种方法制氢,具有理想的应用前景。回答下列问题:
(一)乙醇催化重整制氢
原理:C2H5OH(g)+3H2O(g)![]() 2CO2(g)+6H2(g)△H1
2CO2(g)+6H2(g)△H1
以Ni/凹凸棒石做催化剂,在2L刚性容器中,分别以水醇比为2:1、4:1、6:1、8:1投料(乙醇的起始物质的量相同),反应相同时间测得乙醇转化率随温度变化的关系如图所示。
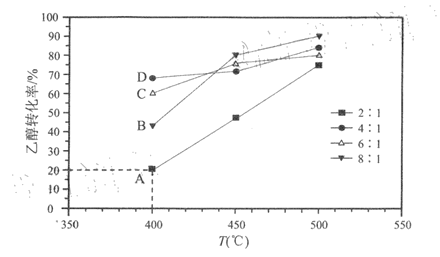
已知:过多的水分子会占据催化剂表面活性位,导致反应速率降低:上图中水醇比为2:1时,各点均已达到平衡状态。
(1)反应热△H1________0(填“>”或“<”)。若乙醇的起始物质的量为n0mol,则K(400℃)=______________(列出计算式)。
(2)400℃时,水醇比过高不利于乙醇转化的原因是____________________________;B、C、D三点中,一定未达到平衡状态的是______________(填标号)。
(二)乙醇氧化制氢
原理:C2H5OH(g)+![]() O2(g)
O2(g)![]() 2CO2(g)+3H2(g) △H2
2CO2(g)+3H2(g) △H2
(3)已知H2(g)+![]() O2(g)
O2(g)![]() H2O(g) △H3,则△H2=_____(用含△H1和△H3的式子表示)。在密闭容器中通入一定量的乙醇和氧气,达到平衡状态后增大容器体积,则混合气体的平均相对分子质量将_________(填“增大”“减小”或“不变”)。
H2O(g) △H3,则△H2=_____(用含△H1和△H3的式子表示)。在密闭容器中通入一定量的乙醇和氧气,达到平衡状态后增大容器体积,则混合气体的平均相对分子质量将_________(填“增大”“减小”或“不变”)。
(三)乙醇电解法制氢
乙醇电解法不仅可以利用乙醇本身的氢,还可以从水中获得氢,且电解乙醇所需电压比电解水的理论电压要低很多。
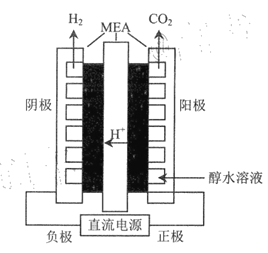
(4)利用如图所示装过(MEA为复杂的膜电极)电解乙醇制氢,阳极的电极反式应为___________,理论上每转移lmol电子,可以产生________L氢气(标准状况下)。
【答案】>  mol4L-4 过多的水分子会占据催化剂表面活性位,导致反应速率降低,则相同时间内乙醇转化率降低(合理即可) B △H2= △H1 +3△H3 减小 C2H5OH+3H2O-12e- = 12 H+ +2 CO2 11.2
mol4L-4 过多的水分子会占据催化剂表面活性位,导致反应速率降低,则相同时间内乙醇转化率降低(合理即可) B △H2= △H1 +3△H3 减小 C2H5OH+3H2O-12e- = 12 H+ +2 CO2 11.2
【解析】
(1)上图中水醇比为2:1时,随着温度升高,乙醇的转化率增大,说明升高温度,平衡向正反应方向移动,说明正反应方向为吸热,故△H1>0;
400℃时,乙醇转化率为20%,根据三等式,则
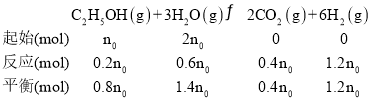
容器的体积为2L,则平衡常数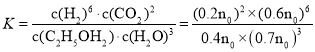 mol4L-4;
mol4L-4;
(2)根据题干信息分析知,水醇比过高不利于乙醇转化的原因是过多的水分子会占据催化剂表面活性位,导致反应速率降低;B、C、D三点中,B点水醇比最高,反应最慢,且转化率最低,但根据平衡移动原理,水醇比越高,即加水越多,达到平衡时,乙醇的转化率应该越大,现在B的转化率在三点中最低,说明B点一定未达到平衡状态;
(3)已知:iC2H5OH(g)+3H2O(g)![]() 2CO2(g)+6H2(g) △H1
2CO2(g)+6H2(g) △H1
iiC2H5OH(g)+![]() O2(g)
O2(g)![]() 2CO2(g)+3H2(g) △H2
2CO2(g)+3H2(g) △H2
iiiH2(g)+![]() O2(g)
O2(g)![]() H2O(g) △H3根据盖斯定律知反应ii=i+3iii,则△H2=△H1+3△H3;该反应为气体体积增大的反应,达到平衡状态后增大容器体积,压强减小,平衡向正反应方向移动,气体的总物质的量增大,则混合气体的平均相对分子质量将减小;
H2O(g) △H3根据盖斯定律知反应ii=i+3iii,则△H2=△H1+3△H3;该反应为气体体积增大的反应,达到平衡状态后增大容器体积,压强减小,平衡向正反应方向移动,气体的总物质的量增大,则混合气体的平均相对分子质量将减小;
(4)根据图示装置分析,阳极失去电子发生氧化反应,生成CO2,电极反应式为:C2H5OH+3H2O-12e-=12H++2CO2;阴极反应为:2H++2e-=H2,根据电极反应式知,每转移lmol电子生成0.5mol氢气,则V(H2)=22.4L/mol×0.5mol=11.2L。

 作业辅导系列答案
作业辅导系列答案【题目】为探究Na与CO2反应的产物,某化学兴趣小组按如图所示装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3
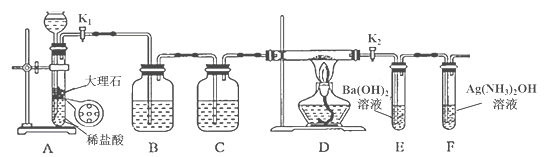
回答下列问题:
(1)B中的溶液为______________。
(2)先称量硬质玻璃管的质量为ml g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g。再进行下列实验操作,其正确顺序是____________(填标号);重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊 e.关闭K1和K2 f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________________________;
(4)探究固体产物中钠元素的存在形式
假设一:只有Na2CO3; 假设二:只有Na2O; 假设三:Na2O和Na2CO3均有;
完成下列实验设计,验证上述假设:
步骤 | 操作和现象 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
(5)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式_____________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |
【题目】锰元素的化合物在多个领域中均有重要应用。
(1)二价锰的3种离子化合物的熔点如表:
物质 | MnCl2 | MnS | MnO |
熔点 | 650℃ | 1610℃ | 2800℃ |
上表3种物质中晶格能最大的是___。
(2)某锰氧化物的晶胞结构如图所示,该氧化物的化学式为___。
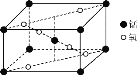
(3)与NO3-互为等电子体的一种分子为___(填化学式)。