题目内容
13.已知Ksp(Mg(OH)2)=1.8×10-11,则Mg(OH)2在pH=12.00的NaOH溶液中Mg2+浓度为( )| A. | 1.8×10-7mol•L-1 | B. | 1.0×10-5 mol•L-1 | ||
| C. | 1.0×10-7 mol•L-1 | D. | 1.8×10-9 mol•L-1 |
分析 已知常温下Mg(OH)2的Ksp=1.8×10-11,pH=12的氢氧化镁溶液中c(OH-)=10-2mol/L,根据Ksp=c(Mg2+)•c2(OH-)计算.
解答 解:已知常温下Mg(OH)2的Ksp=1.8×10-11,pH=12的氢氧化镁溶液中c(OH-)=10-2mol/L,Ksp=c(Mg2+)•c2(OH-),则c(Mg2+)=$\frac{{K}_{sp}}{{c}^{2}(O{H}^{-})}$=$\frac{1.8×1{0}^{-11}}{(1{0}^{-2})^{2}}$=1.8×10-7mol/L,
故选A.
点评 本题考查了溶度积的计算,侧重于基本原理的应用的考查,题目难度不大,注意基础知识的积累即可解答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.某化学反应2A?B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为0.013mol/(L•min).
(2)在实验2,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是催化剂.
 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C1 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C2 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 800℃ | 1.0 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
(1)在实验1,反应在10至20分钟时间内平均速率为0.013mol/(L•min).
(2)在实验2,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是催化剂.
4.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A. | W、Z、Y、X的原子半径依次减小 | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的弱 | |
| D. | Y的气态简单氢化物的热稳定性比W的强 |
1.可逆反应 mA(g)+nB(g)?pC(g),在不同温度T、压强p下,生成物C的物质的量分数x(C)的变化情况,如图所示.下列对该反应的判断正确的是( )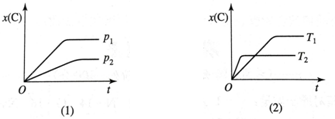

| A. | 吸热反应,m+n<p | B. | 吸热反应,m+n>p | C. | 放热反应,m+n<p | D. | 放热反应,m+n>p |
18.下列说法正确的是( )
| A. | 增大压强,活化分子数增多,化学反应速率一定增大 | |
| B. | 升高温度,活化分子百分数不一定增大,化学反应速率一定增大 | |
| C. | 加入反应物,使活化分子百分数增加,化学反应速率增大 | |
| D. | 使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率一定增大 |
2.甲、乙、丙均为中学化学常见气体单质,A、B、C为常见的化合物.可供参考的信息有:

(I)A和B都极易溶于水,用两根玻璃棒分别蘸A和B的浓溶液后相互靠近,会看到白烟.
(II)甲与乙在一定条件下反应的有关数据为:
分析上述信息回答下列问题:
(1)丙的电子式为:
(2)甲与乙反应生成A的速率为:v(甲)=0.6mol/(L•s).
(3)写出C与NaOH溶液反应生成A的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑.

(I)A和B都极易溶于水,用两根玻璃棒分别蘸A和B的浓溶液后相互靠近,会看到白烟.
(II)甲与乙在一定条件下反应的有关数据为:
| 项目 | 甲 | 乙 | A |
| 起始时 | 3mol/L | 3mol/L | 0 |
| 2s末 | 1.8mol/L | 2.6mol/L | 0.8mol/L |
(1)丙的电子式为:

(2)甲与乙反应生成A的速率为:v(甲)=0.6mol/(L•s).
(3)写出C与NaOH溶液反应生成A的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑.
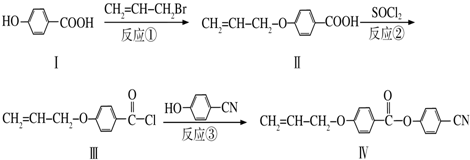
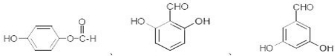 任一种.
任一种.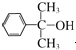 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ.Ⅴ的结构简式是
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ.Ⅴ的结构简式是 .
.