题目内容
10.运用化学原理知识研究化学对于人类的生产生活、科研意义重大.(1)工业上以黄铜矿(主要成分:CuFeS2,其中S为-2价)为原料,采用火法熔炼工艺生产粗铜.CuFeS2中Fe的化合价为+2,熔炼过程中所得炉渣的主要成分有FeO、Fe2O3、SiO2,Al2O3等,若要利用炉渣制取铁红,下列实验操作不需要的是C(填写字母代号).
A.溶解 B.过滤 C.蒸发结晶 D.灼烧
(2)Mg(OH)2是水垢的主要成分之一,用氯化铵溶液浸泡:可以溶解Mg(OH)2,请结合平衡移动原理解释其原因溶液中存在Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),加入氯化铵溶液浸泡时,发生NH4++OH-=NH3•H2O,平衡右移,促进Mg(OH)2的溶解.
(3)研究发现CuCl2溶液中铜、氯元素的存在形式为Cu(H2O)42+、CuCl42-,电解CuCl2溶液一段时间,阳极产生2.24L(标准状况)黄绿色气体,阴极析出红色物质,试计算该过程中共转移电子0.2mol,若要使电解质溶液恢复至原浓度,应向电解后的溶液中加入13.5gCuCl2.
(4)以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料
 采用MnO2.其工作原理如图丙所示.电池放电时Na+由a(填写“a”或“b”,下同)极区移向b极区,该电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
采用MnO2.其工作原理如图丙所示.电池放电时Na+由a(填写“a”或“b”,下同)极区移向b极区,该电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
分析 (1)CuFeS2中Cu、Fe的化合价为+2价,S为-2价;利用炉渣制取铁红,可加入氢氧化钠溶液除去SiO2,Al2O3,然后灼烧可得铁红;
(2)溶液中存在氢氧化镁的溶解平衡,电离出的氢氧根离子可与铵根离子结合生成一水合氨,平衡右移;
(3)电解CuCl2溶液一段时间,阳极产生2.24L(标准状况)黄绿色气体,发生2Cl--2e-=Cl2↑,且n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,阴极析出红色物质,生成铜,电极方程式为Cu2++2e-=Cu;
(4)NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,正极上H2O2发生还原反应,负极电极方程式为BH4-+8OH--8e-=BO2-+6H2O,阳离子向正极移动.
解答 解:(1)CuFeS2中Cu、Fe的化合价为+2价,S为-2价,
利用炉渣制取铁红,可加入氢氧化钠溶液除去SiO2,Al2O3,然后灼烧可得铁红,需要的操作为溶解、过滤、灼烧,不需要蒸发结晶,
故答案为:+2;C;
(2)溶液中存在氢氧化镁的溶解平衡Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),电离出的氢氧根离子可与氯化铵电离出的铵根离子结合生成一水合氨,平衡右移,促进Mg(OH)2的溶解,
故答案为:溶液中存在Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),加入氯化铵溶液浸泡时,发生NH4++OH-=NH3•H2O,平衡右移,促进Mg(OH)2的溶解;
(3)电解CuCl2溶液一段时间,阳极产生2.24L(标准状况)黄绿色气体,发生2Cl--2e-=Cl2↑,且n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,转移0.2mol电子,
阴极析出红色物质,生成铜,电极方程式为Cu2++2e-=Cu,则阴极析出0.1molCu,质量为m(CuCl2)=0.1mol×135.5g/mol=13.5g,则若要使电解质溶液恢复至原浓度,应向电解后的溶液中加入13.5gCuCl2,
故答案为:0.2;13.5gCuCl2;
(4)NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,阳离子向正极移动,正极上H2O2发生还原反应,得到电子生成OH-,其电极反应为:H2O2+2e-=2OH-,负极电极方程式为BH4-+8OH--8e-=BO2-+6H2O,故答案为:a;b;BH4-+8OH--8e-=BO2-+6H2O.
点评 本题考查较为综合,为高考常见题型,侧重于学生分析能力和计算能力的考查,题目涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写,注意化合价的变化.

 阅读快车系列答案
阅读快车系列答案 某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:
某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:| 序号 | 35mL试剂 | 固体 | 混合温度前/℃ | 混合温度后/℃ |
| ① | 水 | 2.5gNaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2gNa2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5gNaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2gNa2CO3 | 20.0 | 25.1 |
(1)写出NaHCO3和盐酸发生反应的离子方程式HCO3-+H+=CO2↑+H2O
(2)由上述实验得出的结论是:Na2CO3溶液与盐酸的反应是放热(填“吸热”或“放热”下同)反应,NaHCO3溶液与盐酸反应是吸热反应
(3)在如图中画出Na2CO3和盐酸反应前后能量变化曲线(标注“反应物总能量”和“生成物总能量”)
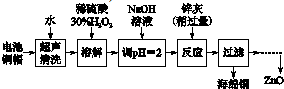
(1)①铜帽溶解时加入H2O2的目的是Cu+H2O2+H2SO4=CuSO4+2H2O (用化学方程式表示).
②铜帽溶解完全后,需将溶液中过量的H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2 2S2O+I2═2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象蓝色褪去且30秒不恢复蓝色.
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会偏高(填“偏高”、“偏低”或“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 9 |
由除去铜的滤液制备ZnO的正确实验步骤依次为:⑤④①②③⑥
①过滤;
②调节溶液pH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;
③过滤、洗涤、干燥;
④调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
⑤向滤液中加入适量30% H2O2,使其充分反应;
⑥900℃煅烧;
(4)Zn(OH)2的溶度积常数为1.2×10-17(mol•L-1)3,当Zn2+沉淀完全时,此时溶液中Zn2+的浓度为1.2×10-7 mol•L-1.
 纳米技术制成的金属燃料、非金属固体燃料等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B均为短周期元素,其原子的第一至第四电离能如下表所示:
纳米技术制成的金属燃料、非金属固体燃料等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B均为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能(KJ•mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1541 | 7733 | 10540 |
(2)ACl2分子中A的杂化类型为sp杂化.
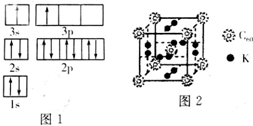
(3)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.基态钾原子的价电子排布式为4S1,该物质中K原子和C60分子的个数比为3:1.
(4)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是N>C>Si,NCl3分子的价层电子对互斥理论模型为正四面体.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则分子中π键的数目为30.
| A. | 该氨水显弱碱性 | |
| B. | 加水稀释过程中,c(H+)/c(OH-)的值减小 | |
| C. | 与同温下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+) | |
| D. | 加入少量NH4Cl 固体,溶液中水的电离平衡:H2O?H++OH-向右移动 |
| A. | 由Zn和稀H2SO4反应制取氢气 | B. | 灼热的碳与二氧化碳反应 | ||
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | D. | 碳酸钙的分解 |
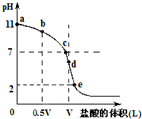 常温时向浓度为0.1mol/L体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
常温时向浓度为0.1mol/L体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题: