题目内容
4.氮、硫的化合物与人类生活和生产有着密切的联系,请回答下列问题:(1)在空气质量报告的各项指标中,有SO2和NO2的指数.SO2是一种无色有毒气体,NO2是一种红棕色(填“无色”或“红棕色”)有毒气体;
(2)氨气极易溶于水,其水溶液显碱(填“酸”、“碱”或“中”)性;
(3)加热时,浓硫酸可与碳发生反应:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O在该反应中,浓H2SO4表现出氧化性(填“吸水”、“脱水”或“氧化”).
分析 (1)二氧化氮为红棕色气体;
(2)氨气与水反应生成一水合氨,一水合氨电离产生氢氧根离子;
(3)依据反应中浓硫酸中硫元素化合价变化解答.
解答 解:(1)二氧化氮为红棕色气体,故答案为:红棕色;
(2)氨气与水反应生成一水合氨,一水合氨电离产生氢氧根离子,溶液显碱性,故答案为:碱;
(3)C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O在该反应中,浓硫酸中硫化合价全部降低,表现氧化性,故答案为:氧化.
点评 本题考查了元素化合物知识,熟悉二氧化氮、氨气、浓硫酸性质是解题关键,题目难度不大.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
14. Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
【数据处理】实验测得p-CP的浓度随时间变化的关系如图
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
【解释与结论】
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
【思考与交流】
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10(其他合理答案均可).
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 3 | |||
| ③ | 298 | 10 | 6.0 | 0.30 | |
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
【解释与结论】
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
【思考与交流】
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10(其他合理答案均可).
12.下表列出了A-R九种元素在周期表中的位置,用元素符号或化学式填空.
(1)这九种元素中:
化学性质最不活泼的是Ar;
金属性最强的是K;
最高价氧化物的水化物碱性最强的碱是KOH;
最高价氧化物的水化物酸性最强的酸是HClO4.
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(3)A、B、C三种元素按原子半径由大到小的顺序排列的为K>Na>Mg.
(4)F的氢化物的电子式 ;G、H 氢化物的稳定性递减的顺序是HCl>HBr.
;G、H 氢化物的稳定性递减的顺序是HCl>HBr.
(5)H元素跟A元素形成的化合物的化学式是NaBr;A2F2的电子式是 ;.
;.
(6)B和F两种元素形成的2:1型化合物属于离子化合物(填“离子化合物”或“共价化合物”),请用电子式表示其形成过程 .
.
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
化学性质最不活泼的是Ar;
金属性最强的是K;
最高价氧化物的水化物碱性最强的碱是KOH;
最高价氧化物的水化物酸性最强的酸是HClO4.
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(3)A、B、C三种元素按原子半径由大到小的顺序排列的为K>Na>Mg.
(4)F的氢化物的电子式
 ;G、H 氢化物的稳定性递减的顺序是HCl>HBr.
;G、H 氢化物的稳定性递减的顺序是HCl>HBr.(5)H元素跟A元素形成的化合物的化学式是NaBr;A2F2的电子式是
 ;.
;.(6)B和F两种元素形成的2:1型化合物属于离子化合物(填“离子化合物”或“共价化合物”),请用电子式表示其形成过程
 .
.
9.下列反应的有机产物中,一定不存在同分异构体的反应是( )
| A. | 1,3-丁二烯(CH2=CH-CH=CH2)与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷( )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 甲苯在一定条件下与足量硝酸发生硝化反应 | |
| D. | 乙醇与HBr发生的取代反应 |
16.油酸的结构简式为CH3(CH2)7CH=CH(CH2)7COOH,下列说法正确的是( )
| A. | 油酸的分子式为C18H33O2 | B. | 油酸是乙酸的同系物 | ||
| C. | 油酸可与氢气发生加成反应 | D. | 1 mol甘油最多可与1 mol油酸酯化 |
14.下列说法中,正确的是( )
| A. | 22.4 L氧气中,一定含有2mol氧原子 | |
| B. | 80 g NaOH溶解在1 L水中,得到溶液的物质的量浓度为2mol/L | |
| C. | 18 g水在标准状况下的体积约为22.4L | |
| D. | 标准状况下,20 mLNH3跟60 mLO2所含分子个数比为1:3 |
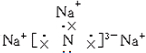 ,该化合物由离子键形成.
,该化合物由离子键形成. ,
, .
.
