题目内容
9.如图为番茄电池,下列说法正确的是( )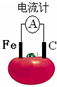
| A. | 一段时间后,铁极质量会变大 | B. | 溶液中的H+向石墨电极移动 | ||
| C. | 电子由石墨电极通过导线流向铁极 | D. | 铁电极是该电池的正极 |
分析 根据金属的活泼性知,铁作负极,C作正极,负极上铁失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,电流从正极沿导线流向负极.
解答 解:A.该原电池中,铁作负极,负极上铁失电子生成亚铁离子进入溶液,所以铁片的质量会变小,故A错误;
B.C作正极,氢离子移向正极,所以溶液中的H+向石墨电极移动,故B正确;
C.铁作负极,C作正极,电流从石墨沿导线流向铁,电子从铁流向石墨,故C错误;
D.铁作负极,C作正极,故D错误.
故选B.
点评 本题考查了原电池原理,为高频考点,侧重于学生的分析能力的考查,难度不大,明确溶液中阴阳离子的移动方向、电极的判断来解答.

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
20.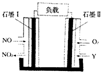 以NO、O2,熔融NaNO3,组成的燃料电池装置如图所示,在使用过程中石墨I生成NO2,Y为一种氧化物,下列说法不正确的是( )
以NO、O2,熔融NaNO3,组成的燃料电池装置如图所示,在使用过程中石墨I生成NO2,Y为一种氧化物,下列说法不正确的是( )
 以NO、O2,熔融NaNO3,组成的燃料电池装置如图所示,在使用过程中石墨I生成NO2,Y为一种氧化物,下列说法不正确的是( )
以NO、O2,熔融NaNO3,组成的燃料电池装置如图所示,在使用过程中石墨I生成NO2,Y为一种氧化物,下列说法不正确的是( )| A. | 石墨Ⅱ电极为正极 | |
| B. | Y为N2O5 | |
| C. | 石墨Ⅰ电极方程式为NO+O2--2e-=NO2 | |
| D. | 不能用NaNO3水溶液代替熔融NaNO3 |
17.下列关于同系物的说法中,错误的是( )
| A. | 同系物具有相同的最简式 | |
| B. | 同系物之间相对分子质量相差14或14的整数倍 | |
| C. | 同系物符合同一通式 | |
| D. | 同系物的化学性质基本相似,物理性质随碳原子数的增加呈规律性变化 |
4.关于化学反应速率、反应限度的下列说法中正确的是( )
| A. | 其他条件不变时,升高温度,化学反应速率加快 | |
| B. | 其他条件不变时,增大浓度,化学反应速率加快 | |
| C. | 化学反应达到反应限度时,反应物的浓度与生成物的浓度相等 | |
| D. | 化学反应的限度是不可以改变的 |
14.下列说法正确的是( )
| A. |  的结构中含有酯基 的结构中含有酯基 | |
| B. | 2-丁烯和 1-丁烯的加氢产物不同 | |
| C. | 1 mol 葡萄糖可水解生成 2 mol 乳酸(C3H6O3) | |
| D. | 油脂和蛋白质都是能发生水解反应的高分子化合物 |
1.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(用元素符号表示,下同)
(2)在最高价氧化物的水化物中碱性最强的化合物的是KOH
(3)写出⑤的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O
(4)用电子式表示元素④与⑥的化合物的形成过程: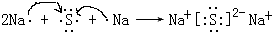
(5)③、⑥的氢化物中,沸点较高的是H2O(用化学式表示) 原因是水分子之间含氢键.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中碱性最强的化合物的是KOH
(3)写出⑤的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O
(4)用电子式表示元素④与⑥的化合物的形成过程:
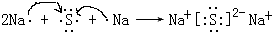
(5)③、⑥的氢化物中,沸点较高的是H2O(用化学式表示) 原因是水分子之间含氢键.
19.下列离子方程式正确的是( )
| A. | 向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3•H2O+H2O | |
| B. | H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2 | |
| C. | 0.1mol/L CuCl2溶液中加入0.1mol/L NaHS溶液:Cu2++2HS-+2H2O=Cu(OH)2↓+2H2S↑ | |
| D. | 用石墨作电极电解AlCl3溶液:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- |
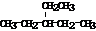 .
.