题目内容
19.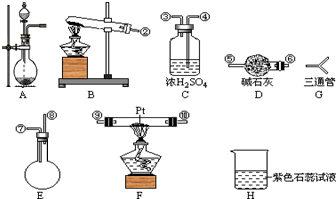 某学生设计氨的催化氧化实验,并将制得的NO进一步氧化为NO2,用水吸收NO2,并检验HNO3的生成.
某学生设计氨的催化氧化实验,并将制得的NO进一步氧化为NO2,用水吸收NO2,并检验HNO3的生成.可供选择的固体药品有:NH4Cl、Ca(OH)2、KClO3、MnO2、NaOH
可供选择的液体药品有:浓氨水、过氧化氢、浓盐酸、水
可供选择的仪器有:如图
另有铁架台、铁夹、铁圈、乳胶管若干,可供选择.设计实验时,A和B两个制气装置允许使用两次,其余装置只能使用一次.
(1)氨氧化制NO,该反应应在装置F中进行.
(2)为快速制NH3和O2,制取NH3的装置最好选择A,其化学反应方程式为NH3•H2O=NH3↑+H2O
.;制取O2的装置最好选择A,其化学反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(3)利用快速制NH3和O2的装置组装,各仪器按气流方向连接的正确顺序为
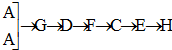 [按装置先后顺序排列]
[按装置先后顺序排列](4)装置C的作用是吸收多余NH3.
(5)装置H中溶液变红,其原因是(用化学方程式表示)4NO2+O2+2H2O=4HNO3.
分析 (1)氨气与氧气在催化剂条件下加热生成一氧化氮和水,依据反应条件和反应物状态选择装置;
(2)要快速制备氨气,则应该是将生石灰加入到浓氨水中,据此选择装置及写出方程式;
双氧水在催化剂条件下,不需要加热就会迅速产生大量氧气,据反应物状态和反应条件选择发生装置并写出方程式;
(3)快速制NH3和O2含有水蒸气,所以需要干燥,用碱石灰进行干燥,然后进入F发生成催化氧化,剩余的氨气需要用浓硫酸吸收,同时还要干燥NO,最后检验硝酸的生成,据此连接仪器;
(4)氨气与浓硫酸反应,可以用浓硫酸吸收过量的氨气;
(5)由于NO2和剩余的氧气溶于水会有硝酸生成,溶液显酸性,因此石蕊试液变为红色.
解答 解:(1)氨气与氧气在催化剂条件下加热生成一氧化氮和水,由于是两种气体之间的反应,所以根据装置的特点可知,应选择装置F制备;
故答案为:F;
(2)要快速制备氨气,则应该是将生石灰加入到浓氨水中,所以选择的装置是A,反应的化学方程式是NH3•H2O=NH3↑+H2O;
双氧水在催化剂条件下,不需要加热就会迅速产生大量氧气,反应物状态为固体与液体,条件不加热,选择装置A;方程式为:2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑;
故答案为:A;NH3•H2O=NH3↑+H2O A;2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑;
(3)快速制NH3和O2含有水蒸气,所以需要干燥,用碱石灰进行干燥,然后进入F发生成催化氧化,剩余的氨气需要用浓硫酸吸收,同时还要干燥NO,最后检验硝酸的生成,所以正确的连接顺序是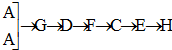 ;
;
故答案为: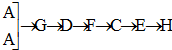 ;
;
(4)C中的浓硫酸用来吸收过来的氨气;
故答案为:吸收多余NH3;
(5)由于NO2和剩余的氧气溶于水会有硝酸生成,溶液显酸性,因此石蕊试液变为红色,反应的化学方程式是:4NO2+O2+2H2O=4HNO3;
故答案为:4NO2+O2+2H2O=4HNO3.
点评 本题考查气体的制备和性质的检验,熟悉发生装置选择的依据、氨气、氧气的制备原理和性质是解题关键,题目难度中等.

 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案| A. | 氢气的燃烧热为285.8 kJ/mol,则水电解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+285.8 kJ/mol | |
| B. | 1 mol甲烷完全燃烧生成CO2和H2O(l)时放出890kJ热量,则甲烷的燃烧热化学方程式为:$\frac{1}{2}$CH4(g)+O2(g)=$\frac{1}{2}$CO2 (g)+H2O(l)△H=-445 kJ/mol | |
| C. | HF与NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol | |
| D. | 由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s)△H<0 |
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
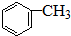
| B. | 用溴水即可鉴别苯酚溶液,2,4-己二烯和甲苯 | |
| C. | 乙酸乙酯和食用植物油均可水解生成乙醇 | |
| D. | 溴乙烷与NaOH乙醇溶液共热生成乙烯 |
| A. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 | |
| B. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入稀硫酸,c(H+)增大,水的电离程度增大 | |
| D. | 95℃纯水的pH<7,说明加热可导致水呈酸性 |
| A. | 64 | B. | 48 | C. | 32 | D. | 16 |
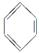 ,B是CH≡CH,C是CH2═CH2,D是CH3CH3.
,B是CH≡CH,C是CH2═CH2,D是CH3CH3. .
. (1)从不同的角度,化学反应可以有不同的分类方法,不同类别的化学反应间又有一定的联系,请在如图的方框中,用图示(每个圆圈代表一类
(1)从不同的角度,化学反应可以有不同的分类方法,不同类别的化学反应间又有一定的联系,请在如图的方框中,用图示(每个圆圈代表一类
 )
)
 (不要求写出反应条件).
(不要求写出反应条件).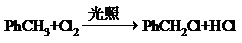 (要求写出反应条件).
(要求写出反应条件).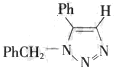 .
.