题目内容
14.海水是一种丰富的资源,工业生产可以从海水中提取许多有用的物质,这些物质广泛应用于生活、生产、科技等砝码,如图1是含碘CCl4溶液得到碘的实验过程.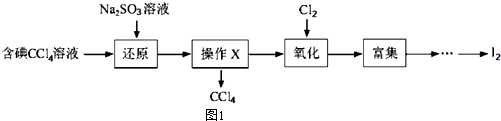
完成下列填空
(1)向含碘溶液中加入稍过量的Na2SO3溶液,其离子方程式为SO32-+I2+H2O=2I-+SO42-+2H+该操作将I2还原为I的目的是将I2还原为I-的目的是使四氯化碳中的碘单质转化为碘离子进入溶液
(2)操作X的名称为分液,所用的主要仪器是分液漏斗
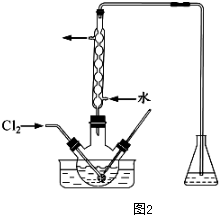
(3)氧化时,在三颈瓶中将含“I”的水溶液用盐酸调至pH约为2,华安满通入Cl2,在40℃左右反应(实验装置如图2所示),实验控制在较低温度下进行原因是防止碘升华或者被氧化、增大氯气溶解度锥形瓶中的溶液为NaOH溶液
(4)浓海水提取镁的工艺流程如图3所示
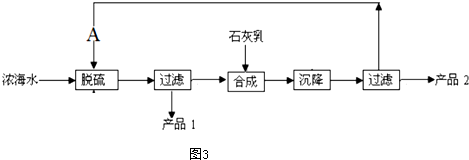
浓海水的主要成分如下
| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g.l-2) | 63.7 | 28.8 | 144.6 | 46.4 |
1L浓海水最多可得到产品2的质量为69.6g.
分析 (1)碘具有强氧化性,能将亚硫酸根离子氧化为硫酸根离子,自身被还原生成碘离子;将碘还原为碘离子,目的是利用分液法除去四氯化碳;
(2)分离互不相溶的液体采用分液方法;使用的仪器是分液漏斗;
(3)碘不稳定,易升华,且温度高时气体难溶解;碘能和强碱溶液反应;
(4)工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁,计算1L溶液中Mg2+的质量,根据Mg2+~Mg(OH)2计算氢氧化镁的质量.
解答 解:(1)碘具有强氧化性,能将亚硫酸根离子氧化为硫酸根离子,自身被还原生成碘离子,离子方程式为SO32-+I2+H2O=2I-+SO42-+2H+;将碘还原为碘离子,目的是利用分液法除去四氯化碳,所以该操作将I2还原为I-的目的是使四氯化碳中的碘单质转化为碘离子进入溶液,
故答案为:SO32-+I2+H2O=2I-+SO42-+2H+;将I2还原为I-的目的是使四氯化碳中的碘单质转化为碘离子进入溶液;
(2)分离互不相溶的液体采用分液方法,分离四氯化碳和水溶液采用分液方法,所以X操作为分液;使用的仪器是分液漏斗,
故答案为:分液;分液漏斗;
(3)碘不稳定,易升华,且温度高时气体难溶解,所以温度较低的原因是:防止碘升华或者被氧化、增大氯气溶解度;碘能和强碱溶液反应,锥形瓶中液体是NaOH溶液,
故答案为:防止碘升华或者被氧化、增大氯气溶解度;NaOH溶液;
(4)工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,用Ca2+沉淀SO42-生成CaSO4沉淀,离子方程式为:Ca2++SO42-=CaSO4↓,采用过滤的方法得到产品1为CaSO4,滤液中加入石灰乳,发生反应为Mg2++2OH-=Mg(OH)2↓,合成中应得到Mg(OH)2沉淀,过滤、干燥的产品2为Mg(OH)2,
溶液中m(Mg2+)=1L×28.8g/L=28.8g,
Mg2+~Mg(OH)2
24g 58g
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×$\frac{58g}{24g}$=69.6g,
故答案为:Ca2++SO42-=CaSO4↓;Mg(OH)2;69.6.
点评 本题考查海水资源综合利用,涉及物质的提纯和分离、氧化还原反应、计算等知识点,知道流程图中发生的反应及基本操作,会根据物质的性质设计实验,难点是④,注意化学语言的准确性,题目难度中等.

 快捷英语周周练系列答案
快捷英语周周练系列答案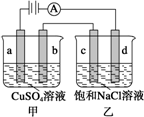
| A. | 向乙中加入适量盐酸,溶液组成可以恢复 | |
| B. | 电解时向乙中滴入酚酞溶液,c电极附近变红 | |
| C. | 当b极有64gCu析出时,c电极产生2g气体 | |
| D. | 甲中a极上的电极反应式为:4OH--4e-=O2↑+2H2O |
①2C(焦炭)+O2(空气)$\frac{\underline{\;高温\;}}{\;}$2CO②Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需其主要原因是( )
| A. | CO过量 | B. | CO与铁矿石接触不充分 | ||
| C. | 炼铁高炉的高度不够 | D. | CO与Fe2O3的反应有一定限度 |
| A. | c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-) | B. | c(Na+)=2c(HS-)+2c(S2-)+c(H2S) | ||
| C. | c(Na+)>c(OH-)>c(HS-)>c(H+) | D. | c(H2S)+c(HS-)+c(H+)=c(OH-) |
| A. | 淀粉、纤维素最终水解产物均为单糖 | |
| B. | 蛋白质最终水解产物是多肽 | |
| C. | 蔗糖、麦芽糖水解产物相同 | |
| D. | 酯在强碱作用下水解生成对应的酸和醇 |
| A. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| B. | 向石灰水中滴加少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑ | |
| D. | 一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O |
 在用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.
在用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.