题目内容
19.铁是当代社会中用量最大的金属之一.磁铁矿是工业上冶炼铁的原料之一,发生的主要反应为:Fe3O4(s)+4CO?3Fe(s)+4CO2
(1)已知:
①Fe3O4(s)+4C(石墨)?3Fe(s)+4CO(g)△H=+646.0kJ/mol
②C(石墨)+CO2(g)?2CO(g)△H=+172.5kJ/mol
由Fe3O4(s)与CO反应生成Fe(s)的热化学方程式是Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-44.0kJ/mol.
(2)T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0mol,10min反应达到平衡时,容器中CO2的浓度是0.4mol/L.
①能证明该反应达到化学平衡的是c(选填字母).
a.容器内压强不再变化
b.容器内CO、CO2物质的量比为1:1
c.容器内气体的质量不再变化
d.生成CO2的速率与消耗CO的速率相等
②CO的平衡转化率是80%.
③l0min内,反应的平均反应速率v (CO2)=0.04mol/(L.min).
④欲提高该反应中CO的平衡转化率,可采取的措施是b(选填字母).
a.提高反应温度 b.移出部分CO2 c.加入合适的催化剂 d.减小容器的容积
⑤T℃时,该反应的平衡常数K=256.
分析 (1)发生反应:Fe3O4+4CO=3Fe+4CO2,根据盖斯定律书写目标热化学方程式;
(2)①可逆反应到达平衡时,正、逆反应速率相等,各组分的浓度、含量不变,由此衍生的一些其它物理量不变,注意判断平衡的物理量应随反应进行发生变化,当该物理量由变化到不变化,说明到达平衡;
②利用三段式计算平衡时各组分浓度、各组分浓度变化量,进而计算CO的转化率;
③根据v=△c△t计算v(CO2);
④欲提高该反应中CO的平衡转化率,应改变条件使平衡向正反应方向移动,结合平衡移动原理方向,注意反应前后气体的体积不变;
⑤结合②中的计算,代入平衡常数K=c4(CO2)c4(CO)计算.
解答 解:(1)已知:①Fe3O4(s)+4C(石墨)?3Fe(s)+4CO(g)△H=+646.0kJ/mol
②C(石墨)+CO2(g)?2CO(g)△H=+172.5kJ/mol
根据盖斯定律,①-②×4可得Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g),故△H=+646.0kJ/mol-4×(+172.5kJ/mol)=-44.0kJ/mol,故反应热化学方程式为:Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-44.0kJ/mol,
故答案为:Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-44.0kJ/mol;
(2)对应可逆反应:Fe3O4(s)+4CO(g)?3Fe(s)+4CO2(g)△H=-44.0kJ/mol,
①a.反应前后气体的体积不变,容器内压强始终不变化,压强不变化不能说明到达平衡,故a错误;
b.容器内CO、CO2物质的量比与CO的转化率有关,平衡时不一定为1:1,故b错误;
c.气体有CO转化为二氧化碳,气体的质量增大,容器内气体的质量不再变化,说明反应到达平衡,故c正确;
d.生成CO2的速率与消耗CO的速率相等,均表示正反应速率,反应始终按速率之比为1:1进行,故d错误,
故答案为:c;
②T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0mol,10min反应达到平衡时,容器中CO2的浓度是0.4mol/L,则:
Fe3O4(s)+4CO(g)?3Fe(s)+4CO2(g)
开始(mol/L):0.5 0
转化(mol/L):0.4 0.4
平衡(mol/L):0.1 0.4
故CO的转化率为0.4mol/L0.5mol/L×100%=80%,
故答案为:80%;
③10min内v(CO2)=0.4mol/L10min=0.04mol/(L.min),
故答案为:0.04mol/(L.min);
④欲提高该反应中CO的平衡转化率,应改变条件使平衡向正反应方向移动,
a.正反应为放热反应,提高反应温度,平衡向逆反应方向移动,CO的转化率降低,故a错误;
b.移出部分CO2,平衡向正反应方向移动,CO的转化率增大,故b正确;
c.加入合适的催化剂,同等程度增大正、逆反应速率,缩短到达平衡的时间,平衡不移动,CO的转化率不变,故c错误;
d.减小容器的容积,压强增大,由于反应气体气体的体积不变,平衡不一定,CO转化率不变,故d错误,
故答案为:b;
⑤由平衡时二氧化碳浓度为0.4mol/L,由②中的计算可知,平衡时CO浓度为0.1mol/L,故该稳定性平衡常数K=c4(CO2)c4(CO)=0.440.14=256,
故答案为:256.
点评 本题比较综合,涉及热化学方程式书写、平衡状态判断、反应速率计算、平衡常数计算、化学平衡移动及计算等,注意平衡状态判断中选择判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化,说明到达平衡,(3)中平衡常数计算时注意:同一反应中化学计量数不同,平衡常数也发生变化,难度中等.

 阅读快车系列答案
阅读快车系列答案(1)基态砷原子的电子排布式为1s22s22p63s23p63d104s24p3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN一之间化学键类型为配位键键,与CN一互为等电
子体的化合物分子式为CO.
(3)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
(4)白磷(P4)是正四面体构型的分子,与氧气作用可形成P4O10,P4O10的分子结构如图
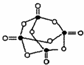 所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH若每个P4 O10分子与四个水分子发生反应,写出该反应的化学方程式P4O10+4H2O=2H4P2O7
(5)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NO2,O3,CH2=CHCHO,HCOOH,
 (PAN)等二次污染物.
(PAN)等二次污染物.①N20结构式可表示为N=N=O,N2O中氮原子的杂化轨道类型为sp2、sp,1mol PAN中含σ键数目为10NA.
②测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr.Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则mn=3(填数字).已知Kr晶体的密度为ρ g/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a=\root{3}{\frac{4M}{ρ•{N}_{A}}}×107nm.
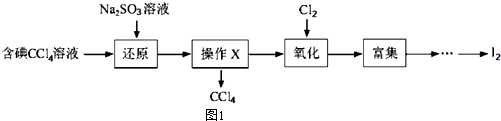
完成下列填空
(1)向含碘溶液中加入稍过量的Na2SO3溶液,其离子方程式为SO32-+I2+H2O=2I-+SO42-+2H+该操作将I2还原为I的目的是将I2还原为I-的目的是使四氯化碳中的碘单质转化为碘离子进入溶液
(2)操作X的名称为分液,所用的主要仪器是分液漏斗
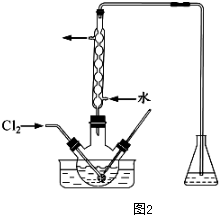
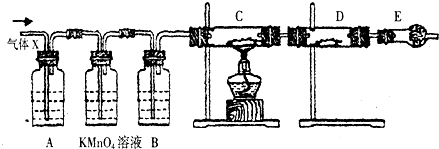
(3)氧化时,在三颈瓶中将含“I”的水溶液用盐酸调至pH约为2,华安满通入Cl2,在40℃左右反应(实验装置如图2所示),实验控制在较低温度下进行原因是防止碘升华或者被氧化、增大氯气溶解度锥形瓶中的溶液为NaOH溶液
(4)浓海水提取镁的工艺流程如图3所示
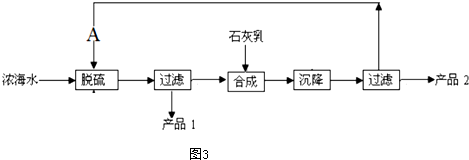
浓海水的主要成分如下
| 离子 | Na+ | Mg2+ | Cl- | SO2−4 |
| 浓度/(g.l-2) | 63.7 | 28.8 | 144.6 | 46.4 |
1L浓海水最多可得到产品2的质量为69.6g.
| A. | 三聚氰胺(分子式:C3H6N6)含氮量很高,可作为牛奶添加剂 | |
| B. | 聚氯乙烯能使溴的四氯化碳溶液褪色 | |
| C. | 为了减少“白色污染”,我国规定商家不得提供塑料袋 | |
| D. | 低碳生活就是节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
| 选项 | 目 的 | 操作或现象 |
| A | 制备无水FeCl3 | 将FeCl3溶液加热蒸干 |
| B | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C | 证明非金属性Cl>C>Si | 向碳酸钠溶液中加盐酸产生气体,将气体先通过饱和NaHCO3溶液,再通入硅酸钠溶液时产生白色沉淀 |
| D | 测定NaCl中混有Na2CO3的量 | 取一定量样品加入足量稀硫酸,将产生的气体直接用足量碱石灰吸收,测得其增重,便可求得原样品中Na2CO3的量 |
| A. | A | B. | B | C. | C | D. | D |
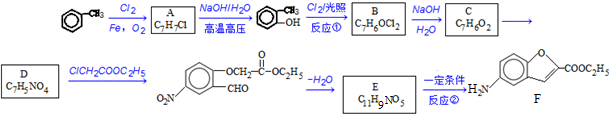
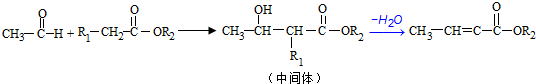
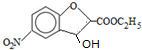 ;反应①的反应类型为取代反应;
;反应①的反应类型为取代反应;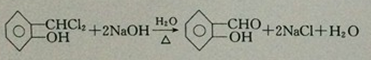 ;ClCH2COOC2H2加热条件下与足量NaOH反应后酸化所得有机物,发生聚合反应的化学方程式为
;ClCH2COOC2H2加热条件下与足量NaOH反应后酸化所得有机物,发生聚合反应的化学方程式为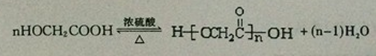 ;
;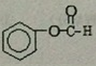 .
.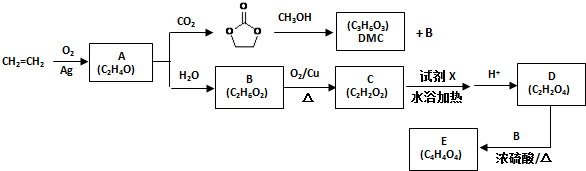
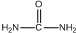 )和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式
)和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式