题目内容
11.合成尿素的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)+Q(Q>0).一定条件下,在10L的恒容密闭容器中,充入2mol NH3和1mol CO2,反应经5min后达到平衡,测得容器中气体的密度为4.2g/L.完成下列填空:
(1)平均反应速率υ(NH3)=0.024mol/(L•min).
(2)下列描述中能说明上述反应已达平衡的是bd.(填序号)
a.2υ正(NH3)=υ逆(H2O)
b.气体的平均相对分子质量不随时间而变化
c.NH3和CO2的比例保持不变
d.气体的压强不再发生变化
(3)为提高尿素的产率,工业上用该反应生产尿素时,合适的反应条件是ad.(填序号)
a.200℃b.800℃c.101kPa d.24000kPa
(4)上述反应所涉及的4种元素中,原子半径从大到小的排列顺序为C>N>O>H;原子核外有2个未成对电子的元素是C、O;反应所涉及的化合物中仅有一种是非极性分子,其电子式为
 .
.(5)下列能用于判断氮、碳两种元素非金属性强弱的是bc.(填序号)
a.气态氢化物沸点b.最高价氧化物对应水化物酸性强弱c.HCN中,碳为+2价d.单质晶体类型.
分析 根据三行式:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)
初起量:2mol 1mol 0
变化量:2x x x
平衡量:2-2x 1-x x,
由反应经5min后达到平衡,测得容器中气体的密度为4.2g/L,所以17(2-2x)+44(1-x)+18x=4.2×10,解之得x=0.6mol;
(1)根据v=$\frac{△C}{△t}$来分析求解:
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)+Q(Q>0)正反应是放热和气体体积缩小的反应,工业上用该反应生产尿素时,合适的反应条件是低温高压;
(4)上述反应所涉及的4种元素分别是C、N、O和H,电子层数越多原子半径越大,电子层数相同时核电荷数越多半径越小;C的核外电子排布为:1s22s22p2,而O的核外电子排布为:1s22s22p4,有2个未成对电子;应所涉及的化合物中仅有一种是非极性分子,是直线型的二氧化碳分子;
(5)判断非金属强弱的方法很多,非金属的最高价氧化物的水化物的酸性强弱,能证明非金属强弱;非金属氢化物的稳定性,能说明非金属性强弱;非金属与氢气化合的难易程度,能说明非金属性的强弱.
解答 解:(1)根据v=$\frac{△C}{△t}$=$\frac{\frac{0.6×2}{10}}{5}$=0.024mol/(L•min),故答案为:0.024mol/(L•min);
(2)a.2υ正(NH3)=υ逆(H2O),速度之比不等以应物质的计量数之比,故错误;
b.气体的平均相对分子质量不随时间而变化,说明正逆反应速率相等,故正确;
c.NH3和CO2的比例一直保持不变,故错误;
d.气体的压强不再发生变化,说明气体的物质的量不变,故正确;故选b d;
(3)2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)+Q(Q>0)正反应是放热和气体体积缩小的反应,工业上用该反应生产尿素时,合适的反应条件是低温高压,故选:a d;
(4)上述反应所涉及的4种元素分别是C、N、O和H,电子层数越多原子半径越大,电子层数相同时核电荷数越多半径越小,所以半径大小为:C>N>O>H;原子核外有2个未成对电子的元素是C、O;二氧化碳分子的电子式为: ,故答案为:C>N>O>H;C、O;
,故答案为:C>N>O>H;C、O; ;
;
(5)a.与气态氢化物沸点无关,故错误;b.最高价氧化物对应水化物酸性强弱,越强非金属性越强;故正确;c.HCN中,碳为+2价,说明氮吸引共用电子对能力强,故正确;d.与单质晶体类型无关,故错误;故选:bc.
点评 本题考查了化学平衡的判断、化学反应速率、非金属性强弱等知识点,难度不大,化学平衡状态的判断是高考的热点,综合性强,难度中等.

 一线名师权威作业本系列答案
一线名师权威作业本系列答案| A. | 银氨溶液或新制Cu(OH)2均能检验糖尿病人尿液中的葡萄糖 | |
| B. | 在燃煤中加入适量生石灰,可以减少二氧化硫的排放 | |
| C. | 铜制品在潮湿环境中的腐蚀比干燥环境中快 | |
| D. | 生活中的水杯、奶瓶、食物保鲜膜等可以使用聚氯乙烯来制造 |
下列推断正确的是( )
| A. | 若CO的燃烧热为△H3,则H2的燃烧热为△H3-△H1 | |
| B. | 反应CH4(g)+CO2(g)═2CO(g)+2H2(g)的△H=△H${\;}_{{\;}_{2}}$-△H1 | |
| C. | 若反应②的反应物总能量低于生成物总能量,则△H2<0 | |
| D. | 若等物质的量的CO和H2完全燃烧生成气态产物时前者放热更多,则△H1>0 |
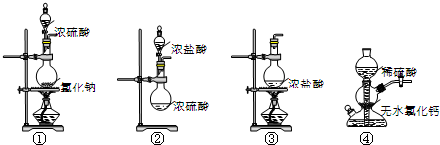
| A. | ①④ | B. | ②③ | C. | ①②③ | D. | ①③④ |
| A. |  制取收集 | B. |  排液收集 | C. |  尾气吸收 | D. |  喷泉实验 |
 碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其它条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R=n(C2H3OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是( )
碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其它条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R=n(C2H3OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是( )| A. | 该反应的逆反应△H>0 | |
| B. | 增大反应物中CH3OCOOCH3的浓度能提高碳酸甲乙酯的平衡转化率 | |
| C. | 650℃,反应物配比为1:1时,平衡常数K=6 | |
| D. | 当C2H5OCOOC2H5与CH3OCOOC2H5生成速率比为1:2时,反应达到平衡状态 |
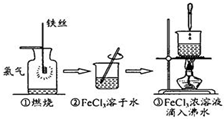
| A. | 实验①、③反应制得的物质均为纯净物 | |
| B. | 实验②、③均未发生氧化还原反应 | |
| C. | 实验②、③均为放热反应 | |
| D. | 实验①、②所涉及的物质均为电解质或非电解质 |