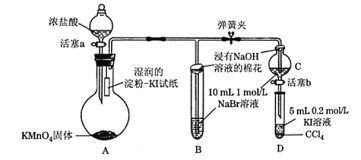
题目内容
【题目】元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值。
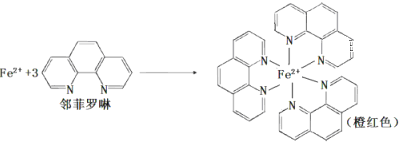
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:
FeCl3+2NH2OHHCl= 4FeCl2+N2O↑+6HCl+H2O
① Fe3+在基态时,核外电子排布式_____;
② 羟胺中(NH2OH)采用sp3杂化的原子有______,三种元素电负性由大到小的顺序为______;
③ Fe2+与邻啡罗啉(用A表示)形成的配合物[FeA3] 2+中,Fe2+的配位数为____;
④N2O分子的空间构型为______(用文字描述)。
(2)氢的规模化制备是氢能应用的基础。在光化学电池中,以紫外线照钛酸锶电极时,可产生电流。钛酸锶晶体结构如图所示,则钛酸锶的化学式为_____。
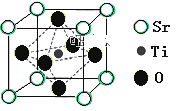
【答案】 [Ar]3d5 N,O O>N>H 6 直线型 SrTiO3
【解析】试题(1)①Fe3+在基态时,核外共有23个电子,电子排布式为[Ar]3d5 ;② 根据价层电子对互斥理论,由VSEPR模型可知羟胺中(NH2OH)采用sp3杂化的原子有N,O; 三种元素电负性由大到小的顺序为O>N>H ;③ 配合物[FeA3] 2+中,Fe2+的配位数为6 ;④根据价层电子对互斥理论,N2O分子中,a=6,x=2,b=3,则中心原子上的孤对电子数=0,VSEPR模型可知N2O的空间构型为直线型;(2)由均摊法可知,在钛酸锶的晶胞中含有Sr的个数为8×1/8=1,含Ti的个数为1,含O的个数为6×1/2=3,所以化学式为SrTiO3 。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1)X在元素周期表中的位置为____;画出X的简单离子结构示意图____。已知X元素的一种原子,其中子数为10,写出这种原子的原子符号_______。
(2)四种元素简单离子的半径由大到小为______(用离子符号表达)。
(3)W、X的最简单氢化物稳定性为____>____(填化学式)。
(4)Z最高价氧化物的水化物与Y最高价氧化物对应水化物反应的化学方程式为___ 。