题目内容
【题目】一定条件下,将一定物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 min后测得:A的转化率达到了最大值,且A和B的转化率相等,C的平均反应速率为0.2 mol/(L·min),D的浓度为0.5 mol/L。
xC(g)+2D(g),经5 min后测得:A的转化率达到了最大值,且A和B的转化率相等,C的平均反应速率为0.2 mol/(L·min),D的浓度为0.5 mol/L。
(1)判断:此反应此时_______(填“是”或“否”)达到了平衡状态。
(2)反应开始前容器中的A和B的物质的量之比为n(A):n(B)=_______。
(3)B的平均反应速率v(B)=________mol/(L·min)。
(4)x的值为________。
【答案】是 3:1 0.05 4
【解析】
(1)由于A的转化率达到了最大值,且A和B的转化率相等,此时已经达到了平衡状态,故答案为:是。
将一定物质的量的A、B混合于2L的密闭容器中,经5min后,C的平均反应速率为0.2 mol/(L·min),D的浓度为0.5mol/L,则生成的C为0.2mol/(L·min)×2L×5min=2mol,D为0.5mol/L×2L=1mol,
3A(g)+B(g)![]() xC(g)+2D(g)
xC(g)+2D(g)
起始(mol) a b 0 0
变化(mol) 1.5 0.5 2 1
5min(mol) 2 1
(2)由于A和B的转化率相等,则![]() ,则反应开始前容器中的A和B的物质的量之比为n(A):n(B)=a:b=3:1,故答案为:3:1。
,则反应开始前容器中的A和B的物质的量之比为n(A):n(B)=a:b=3:1,故答案为:3:1。
(3)由题意可知D的平均反应速率为v(D)=![]() =0.1 mol/(L·min),化学方程式中反应速率之比等于化学计量数之比,所以B的平均反应速率v(B)=1/2v(D)=
=0.1 mol/(L·min),化学方程式中反应速率之比等于化学计量数之比,所以B的平均反应速率v(B)=1/2v(D)=![]() ×0.1 mol/(L·min)=0.05mol/(L·min),故答案为:0.05。
×0.1 mol/(L·min)=0.05mol/(L·min),故答案为:0.05。
(4)根据化学方程式中反应速率之比等于化学计量数之比,v(C):v(D)=0.2mol/(L·min):0.1mol/(L·min)=2:1,则x=4,故答案为:4。

【题目】下列说法正确的是( )
①增大浓度,或加热或加压,或使用催化剂,一定可以加快反应速率.
②气态氢化物的稳定性:H2O>NH3>SiH4
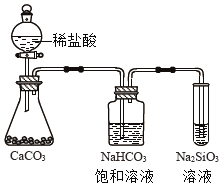
③如图所示实验可证明元素的非金属性:Cl>C>Si
|
④用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
A. ①②B. ②③C. ③④D. ②④
【题目】汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
II | 400 | 0.4 | 0.4 | 0 | 0 | ||
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列说法正确是
A. 容器I中达到平衡所需时间2s,则v(N2)=0.06 molL-1·s-1
B. 该反应的ΔS<0、ΔH<0
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆
【题目】根据表中提供的部分短周期元素原子半径及主要化合价的信息,回答下列问题
元素代号 | A | B | C | D | E | F | G |
原子半径/nm | 0.186 | 0.160 | 0.143 | 0.112 | 0.104 | 0.099 | 0.066 |
主要化合价 | +1 | +2 | +3 | +2 | +6、-2 | +7、-1 | -2 |
(1)A在元素周期表中位置是____。
(2)B的离子结构示意图:_____,
(3)C单质与A的最高价氧化物对应的水化物反应的离子方程式:____。
(4)元素最高价氧化物对应的水化物酸性最强的是:____ (写化学式)。
(5)A元素与F元素形成的化合物的电子式 _____。