题目内容
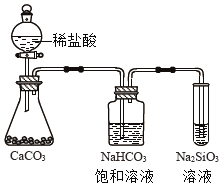
【题目】为验证卤素单质氧化性的相对强弱,某学习小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
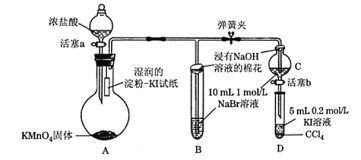
实验过程:
Ⅰ. 打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ. 当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ. 当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
回答问题:
(1)A中产生黄绿色气体,其电子式是_____。实验室在加热条件下制取该气体的离子方程式为_______。
(2)验证氯气的氧化性强于碘单质的实验现象是____________。
(3)C中溶液发生反应的离子方程式是_______________。
(4)过程Ⅲ实验的目的:甲同学认为试管B的作用就是吸收尾气,防止多余Cl2污染空气,因此B中盛装的最佳试剂应该为________。
乙同学经分析认为,B中溶液由黄色变为棕红色,发生反应的化学方程式为____________,以此说明C中_________,从而得出D中氧化I-的氧化剂必为Br2,因此B装置是必不可少的。
(5)过程Ⅳ为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下试管D震荡,静置,观察到的现象为___________,发生反应的离子方程式为_________。
(6)氯、溴、碘单质的氧化性逐渐减弱的本质原因:同主族元素从上到下_________,得电子能力逐渐减弱。
【答案】![]() MnO2+4H++2Cl-
MnO2+4H++2Cl-![]() Mn2+ +2H2O+Cl2↑ 淀粉KI试纸变蓝 Cl2+2Br-=Br2+2Cl- NaOH溶液 Cl2+2 NaBr=Br 2+2NaCl Br-过量,溶液中没有Cl2 试管中溶液分层,下层溶液呈紫红色 Br 2+2I-=I2+2Br- 电子层数逐渐增多,原子半径逐渐增大
Mn2+ +2H2O+Cl2↑ 淀粉KI试纸变蓝 Cl2+2Br-=Br2+2Cl- NaOH溶液 Cl2+2 NaBr=Br 2+2NaCl Br-过量,溶液中没有Cl2 试管中溶液分层,下层溶液呈紫红色 Br 2+2I-=I2+2Br- 电子层数逐渐增多,原子半径逐渐增大
【解析】
A中滴加浓盐酸后,发生反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,生成黄绿色气体Cl2,在A、B、C中分别发生反应:Cl2+2KI=2KCl+I2,Cl2+2NaBr=2NaCl+Br2,Cl2+2NaBr=2NaCl+Br2,由于B、C中生成了Br2而使溶液变为黄色,打开活塞b,C中生成的Br2在D中发生反应:Br2+2KI=2KBr+I2。过程Ⅲ实验,当B中黄色溶液继续通入过量Cl2时,溶液变为红棕色,以此为对照,说明C中黄色溶液无Cl2,从而排除Cl2对溴置换碘实验的干扰,据此答题。
(1)A中产生黄绿色气体为氯气,氯原子间形成1对共用电子对,电子式为:![]() ,实验室用二氧化锰与浓盐酸在加热条件下反应制取氯气,离子方程式为MnO2+4H++2Cl-
,实验室用二氧化锰与浓盐酸在加热条件下反应制取氯气,离子方程式为MnO2+4H++2Cl-![]() Mn2+ +2H2O+Cl2↑,故答案为:
Mn2+ +2H2O+Cl2↑,故答案为:![]() ,MnO2+4H++2Cl-
,MnO2+4H++2Cl-![]() Mn2+ +2H2O+Cl2↑。
Mn2+ +2H2O+Cl2↑。
(2)因Cl2的氧化性大于I2的氧化性,可发生反应:Cl2+2I-=I2+2Cl-,I2能使淀粉变蓝;故答案为:淀粉KI试纸变蓝。
(3)因Cl2的氧化性大于Br2的氧化性,可发生反应:Cl2+2Br-=Br2+2Cl-,故答案为:Cl2+2Br-=Br2+2Cl-。
(4)Cl2是有毒的酸性气体,应用碱液吸收,因此B中盛装的最佳试剂应该为NaOH溶液,为防止多余Cl2污染空气;B中溶液由黄色变为棕红色,说明生成了Br2,发生反应的化学方程式为Cl2+2NaBr=Br2+2NaCl,以此说明C中Br-过量,溶液中没有Cl2,从而得出D中氧化I-的氧化剂必为Br2,故答案为:NaOH溶液,Cl2+2NaBr=Br2+2NaCl,Br-过量,溶液中没有Cl2。
(5)打开活塞b,将少量C中溶液滴入D中,发生反应:Br2+2I-=I2+2Br-,关闭活塞b,取下D震荡,静至后CCl4层溶液变为紫(或紫红)色,故答案为:试管中溶液分层,下层溶液呈紫红色,Br 2+2I-=I2+2Br-。
(6)因同一主族元素,从上到下,电子层数依次增多,原子半径逐渐增大,元素的非金属性逐渐减弱,得电子能力逐渐减弱;故答案为:电子层数依次增多,原子半径逐渐增大.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】下列说法正确的是( )
①增大浓度,或加热或加压,或使用催化剂,一定可以加快反应速率.
②气态氢化物的稳定性:H2O>NH3>SiH4
③如图所示实验可证明元素的非金属性:Cl>C>Si
|
④用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
A. ①②B. ②③C. ③④D. ②④
【题目】汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
II | 400 | 0.4 | 0.4 | 0 | 0 | ||
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列说法正确是
A. 容器I中达到平衡所需时间2s,则v(N2)=0.06 molL-1·s-1
B. 该反应的ΔS<0、ΔH<0
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆