题目内容
8.(1)实验室从海带中提取碘的流程如图1:①在进行实验b的过程中,可以选择的有机溶剂是BC.
A.酒精 B.四氯化碳 C.苯
②从I2的有机溶液中提取碘的装置如图2所示,请指出仪器d的名称蒸馏烧瓶.冷凝管中的水流方向是由f至e(填“由e至f”或“由f至e”)
(2)图3是实验室制取乙酸乙酯的实验装置,回答下列问题:
①在A试管中加入试剂的顺序是C.
A.先浓硫酸再乙醇后乙酸 B.先浓硫酸再乙酸后乙醇 C.先乙醇再浓硫酸后乙酸
②在试管B中常加入饱和的碳酸钠溶液(填写试剂)来接收乙酸乙酯,分离出乙酸乙酯的主要仪器是分液漏斗.
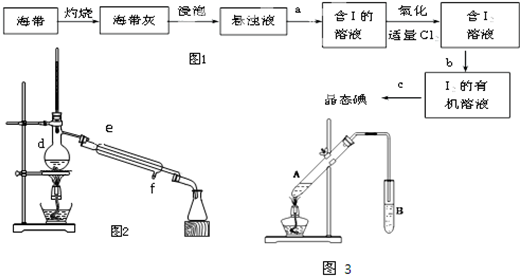
分析 (1)海带灼烧后溶解,以离子形式存在,a为过滤,得到含碘离子的溶液,再加氯气为氧化剂,可氧化碘离子生成碘单质,b为萃取,得到碘的有机溶液,c为蒸馏,
①萃取剂的选取标准为:萃取剂和原溶剂不互溶、萃取剂和溶质不反应、溶质在萃取剂中的溶解度远远大于在原溶剂中的溶解度;
②该仪器是蒸馏烧瓶;冷却水下进上出,在冷凝管中停留时间上,效果好;
(2)①为防止酸液飞溅,应先加入乙醇,然后在加入浓硫酸,最后加入乙酸;
②饱和碳酸钠溶液能吸收乙醇、能和乙酸反应,能降低乙酸乙酯的溶解度.
解答 解:(1)①萃取剂的选取标准为:萃取剂和原溶剂不互溶、萃取剂和溶质不反应、溶质在萃取剂中的溶解度远远大于在原溶剂中的溶解度,四氯化碳和苯都符合萃取剂标准,乙醇易和水互溶,所以能作萃取剂的为BC,故选BC;
②仪器d的名称是蒸馏烧瓶,冷凝管中的水流方向是由f至e,故答案为:蒸馏烧瓶;由f至e;
(2)①为防止酸液飞溅,应先加入乙醇,然后在加入浓硫酸,乙酸价格昂贵且易挥发,为提高醋酸的利用率,所以最后加入醋酸,故选C;
②乙醇极易溶于水,乙酸能和碳酸钠反应生成可溶性的醋酸钠、二氧化碳和水,乙酸乙酯在饱和碳酸钠溶液中的溶解度小于在水溶液中的溶解度,所以B中试剂为饱和碳酸钠溶液,与乙酸乙酯分层后分液需要的仪器为分液漏斗,故答案为:饱和碳酸钠溶液;分液漏斗.
点评 本题考查物质的分离提纯,为高频考点,把握物质的性质、混合物分离方法、乙酸乙酯制备实验等为解答的关键,综合性较强,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
| A. | 正极附近的S042-离子浓度逐渐增大 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 铜片上有H2逸出 | |
| D. | 溶液的pH逐渐变小 |
19.关于硝酸的说法正确的是( )
| A. | 浓硝酸见光或受热易分解,必须保存在棕色瓶中 | |
| B. | 浓HNO3是种强氧化剂,但只能使湿润蓝色的石蕊试纸显红色而不褪色 | |
| C. | 稀HNO3和活泼金属反应时主要得到氢气 | |
| D. | 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
16.下列排列顺序正确的是( )
| A. | 粒子半径:Al3+>Mg2+>F- | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
3.下列关于有机化合物的说法正确的是( )
| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | |
| B. | 丙烷(C3H8)有两种同分异构体 | |
| C. | 乙烯和苯分子中均含有碳碳双键 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
13.含有一个-C≡C-的炔烃与氢气发生加成反应后的产物的结构简式如图所示,此炔烃可能的结构有( )
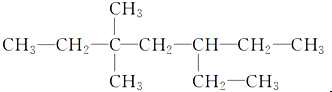
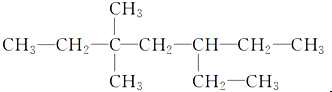
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
20.在一定条件下,RO3-与R-可发生反应:RO3-+5R-+6H+═3R2+3H2O,下列关于R元素的叙述中,正确的是( )
| A. | 元素R位于周期表中第ⅦA族 | |
| B. | RO3-中的R只能被还原 | |
| C. | R2在常温常压下一定是气体 | |
| D. | 若1 mol RO3-参与该反应,则转移的电子的物质的量为10mol |
 .
.