题目内容
17.一个原电池的总反应式为Fe+Cu2+=Fe2++Cu,该原电池的组成可能为( )| A | B | C | D | |
| 正极 | Fe | C | Cu | Zn |
| 负极 | Cu | Fe | Fe | Fe |
| 电解质溶液 | CuSO4 | H2SO4 | CuCl2 | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
分析 该反应中Fe元素化合价由0价变为+2价、Cu元素化合价由+2价变为0价,所以Fe作负极、不如Fe活泼的金属或导电的非金属作正极,含铜离子的溶液为电解质,据此分析.
解答 解:由总反应式为Fe+Cu2+=Fe2++Cu可知,Fe为负极,不如Fe活泼的金属或导电的非金属作正极,含铜离子的溶液为电解质,故选C.
点评 本题考查了原电池的知识,属于基础性知识的考查,题目难度不大,明确原电池的工作原理、构成条件是答题的关键,注意相关知识的积累和总结.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
7.下列有关金属及其合金的说法正确的是( )
| A. | 锂与氧气反应时,反应条件不同产物不同 | |
| B. | 铝箔在空气中受热可以熔化且会发生剧烈燃烧 | |
| C. | 合金的熔点比其成分金属的熔点低,所以钾钠合金可以做原子反应堆的导热剂 | |
| D. | 合金中至少含两种金属 |
8.下列文字表述与反应方程式对应且正确的是( )
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| B. | 用醋酸除去水垢:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | 甲苯与浓硝酸和浓硫酸的混合物反应: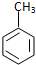 +3HNO3$→_{△}^{浓H_{2}SO_{4}}$ +3HNO3$→_{△}^{浓H_{2}SO_{4}}$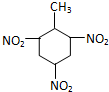 +3H2O +3H2O | |
| D. | 实验室用液溴和苯制溴苯: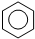 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$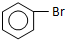 +HBr +HBr |
5.把一块镁铝合金投入到过量1mol/L HCl溶液里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图A所示.下列说法中不正确的是( )
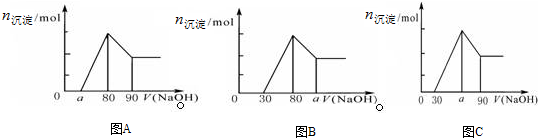

| A. | a的取值范围为 0≤a<50 | |
| B. | $\frac{n(Mg)}{n(Al)}$的最大值为2.5 | |
| C. | 若将关系图改为B图时,则a的取值范围为80<a<90 | |
| D. | 若将关系图改为C图时,则a的取值范围为75<a<90 |
12.有关乙烯有下列叙述:①乙烯溶于水后可得乙醇 ②乙烯能发生加聚反应 ③乙烯能与溴水发生加成反应 ④乙烯是无色难溶于水的气体 其中正确的是( )
| A. | 只有② | B. | ①和③ | C. | ②和③ | D. | ②③④ |
6.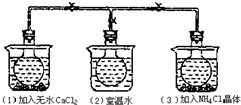 如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯中.在(1)中加入无水CaCl2,在(3)中加入NH4Cl晶体,(2)中不加任何物质,发现(1)中NO2红棕色变深,(3)中NO2红棕色变浅,下列叙述不正确的是( )
如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯中.在(1)中加入无水CaCl2,在(3)中加入NH4Cl晶体,(2)中不加任何物质,发现(1)中NO2红棕色变深,(3)中NO2红棕色变浅,下列叙述不正确的是( )
 如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯中.在(1)中加入无水CaCl2,在(3)中加入NH4Cl晶体,(2)中不加任何物质,发现(1)中NO2红棕色变深,(3)中NO2红棕色变浅,下列叙述不正确的是( )
如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯中.在(1)中加入无水CaCl2,在(3)中加入NH4Cl晶体,(2)中不加任何物质,发现(1)中NO2红棕色变深,(3)中NO2红棕色变浅,下列叙述不正确的是( )| A. | CaCl2溶于水时放出热量 | B. | 烧瓶(1)中气体的压强增大 | ||
| C. | NH4Cl溶于水时放出热量 | D. | 烧瓶(3)中气体的压强减小 |
7.下列不是海水淡化主要方法的是( )
| A. | 电解法 | B. | 离子交换法 | C. | 电渗析法 | D. | 干馏法 |
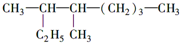 的名称是3,4一二甲基辛烷,
的名称是3,4一二甲基辛烷, ,1mol该烃完全燃烧需消耗氧气18.5mol,
,1mol该烃完全燃烧需消耗氧气18.5mol,