题目内容
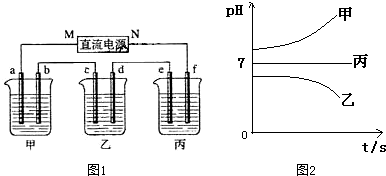
12.某待测溶液中可能含有SO42-、SO32-、CO32-、HCO3-、NO3-、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出).
请回答下列问题:(1)根据上述框图信息填写下表(不能确定的不填):
| 肯定存在的离子 | 肯定没有的离子 | |
| 化学式或离子符号 |
(3)若Mn+位于第三周期,则要确定它具体是何种离子的方法是做焰色反应实验,观察到黄色火焰,则说明是钠.
分析 (1)由沉淀A与稀硝酸反应仍得到白色沉淀知白色沉淀D为BaSO4,由于还生成气体D,气体D可能为N0,还可能是CO2,故溶液中SO42-、SO32-至少有一种,SO32-、CO32-至少有一种;由每次实验所用试剂均足量知溶液A中含有Ba2+,在加入碱后能得到白色沉淀B,则原待测溶液中一定含有HCO3-;溶液B中加入足量的氯水后仍得到无色溶液,说明原待测液中无Br-,不能确定是否有NO3-、CO32-、Cl-;
(2)根据溶液中SO42-、SO32-至少有一种,SO32-、CO32-至少有一种可知沉淀A的可能成分;若气体D遇空气变红色时,表明D中肯定有NO,沉淀D中肯定有BaSO3,据此写出离子方程式;
(3)处于第三周期的金属阳离子有Na+、Mg2+、Al3+,由于Al3+与HCO3-不能大量共存,故金属阳离子不可能是Al3+,即Mn+只能是Na+或K+,可通过焰色实验来确定是镁还是钠,
解答 解:(1)沉淀A与稀硝酸反应仍得到白色沉淀知白色沉淀D为BaSO4,由于还生成气体D,气体D可能是稀硝酸与SO32-发生氧化还原反应生成的N0,还可能是稀硝酸与CO32-反应CO2,或两者均有,故溶液中SO42-、SO32-至少有一种,SO32-、CO32-至少有一种;由每次实验所用试剂均足量知溶液A中含有Ba2+,在加入碱后能得到白色沉淀B,则原待测溶液中一定含有HCO3-;溶液B中加入足量的氯水后仍得到无色溶液,说明原待测液中无Br-,不能确定是否有NO3-、CO32-、Cl-,
根据以上分析可知,原待测溶液中一定含有HCO3-;一定没有无Br-;故答案为:
| 肯定存在的离子 | 肯定不存在的离子 | |
| 化学式或离子符号 | HCO${\;}_{3}^{-}$ | Br- |
若气体D遇空气变红色时,表明D中肯定有NO,沉淀A中肯定有BaSO3,生成沉淀D的离子方程式为:3BaSO3+2H++2NO3-═2NO↑+3BaSO4↓+H2O,
故答案为:BaSO3;BaSO3、BaSO4;BaCO3、BaSO4;BaCO3、BaSO3;BaSO3、BaCO3、BaSO4;3BaSO3+2H++2NO3-═2NO↑+3BaSO4↓+H2O;
(3)处于第三周期的金属阳离子有Na+、Mg2+、Al3+,由于Al3+与HCO3-不能大量共存,故金属阳离子不可能是Al3+,即Mn+只能是Na+或K+,可通过焰色实验来确定是镁还是钠,故答案为:做焰色反应实验,观察到黄色火焰,则说明是钠.
点评 本题考查了常见阴阳离子的检验方法,注意根据实验现象判断离子共存,要掌握根据实验现象判断存在的离子,排除与该离子反应的离子,本题难度中等

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:2 |
| A. | 研制乙醇汽油代替汽油作汽车燃料 | |
| B. | 采用银作催化剂,用乙烯和氧气反应制取环氧乙烷( ) ) | |
| C. | 在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水 | |
| D. | 用铜和稀HNO3反应制取Cu(NO3)2 |
| A. | 78g过氧化钠固体与足量的水反应,转移的电子数目为2NA | |
| B. | Fe在1molCl2中充分燃烧,转移的电子数目为3NA | |
| C. | 将含有0.1molFeCl3的FeCl3饱和溶液,滴入沸水中加热形成Fe(OH)3胶体,所含的胶体粒子数目少于0.1NA | |
| D. | 足量的MnO2粉末与含有4molHCl的浓盐酸充分反应,转移的电子数目为2NA |
| A. | 锂与氧气反应时,反应条件不同产物不同 | |
| B. | 铝箔在空气中受热可以熔化且会发生剧烈燃烧 | |
| C. | 合金的熔点比其成分金属的熔点低,所以钾钠合金可以做原子反应堆的导热剂 | |
| D. | 合金中至少含两种金属 |
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
(1)M为电源的负极(填写“正”或“负”),甲电解质为NaCl(填化学式).
(2)计算电极f上生成的气体在标准状况下的体积:1.4L.
(3)写出乙烧杯的电解池反应4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3.
(4)若电解后甲溶液的体积为25L,则该溶液的pH为12.
(5)要使丙恢复到原来的状态,应加入2.25 gH2O.(填写化学式)
| A. | 原子半径:D>E>B>A | |
| B. | C和E的单质可通过电解饱和的CE水溶液获得 | |
| C. | C与A形成的两种化合物中化学键类型和晶体类型完全相同 | |
| D. | A、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
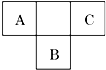 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍. .
. .
.