题目内容
10.相邻三个周期的五种元素,A、B、C、D、E原子序数依次增大.B、C、D在同一周期,B的+4价氧化物与+4价硫化物的相对分子质量之比为11:19.且B与A、B与C均能形成气态化合物分子;而D与E能形成离子化合物ED2,该两种离子的电子层架构相同,由此推断A是H,B是C,C是N,D是O,E是Si.分析 A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B的+4价氧化物与+4价硫化物的相对分子质量之比为11:19,设B的相对原子质量为x,列式计算得出x=12,即可确定B为C元素;
B、C、D在同一周期,原子序数依次增大,且B与A、B与C均能形成气态化合物分子,那么C应为O,那么A为H元素;
而D与E能形成离子化合物ED2,该两种离子的电子层架构相同,即核外电子排布相同,那么E为Si,据此填空即可.
解答 解:A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B的+4价氧化物与+4价硫化物的相对分子质量之比为11:19,设B的相对原子质量为x,由题意得出:$\frac{x+16×2}{x+32×2}=\frac{11}{19}$,x=12,那么B为C元素;
B、C、D在同一周期,原子序数依次增大,且B与A、B与C均能形成气态化合物分子,那么C应为O,那么A为H元素;
而D与E能形成离子化合物ED2,该两种离子的电子层架构相同,即核外电子排布相同,那么E为Si,
故答案为:H;C;N;O;Si.
点评 本题主要考查的是元素的推断,充分利用题给信息得出B为碳元素是解决本题的关键,还要熟悉常见分子晶体和常见元素的化合价,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.下列除杂方法可行的是( )
| A. | 用过量氨水除去AlCl3溶液中的FeCl3 | |
| B. | 用饱和Na2CO3溶液除去CO2中HCl | |
| C. | 用Br2除去KBr溶液中的KCl | |
| D. | 用CuO除去CuCl2中的FeCl3 |
15.有①纤维素;②环己烷;③苯;④乙酸;取等质量的上述有机物分别在过量氧气中完全燃烧,其中耗氧量由大到小排列顺序正确的是( )
| A. | ①②③④ | B. | ②③①④ | C. | ④①③② | D. | ③④①② |
2.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 15g甲基(-CH3)所含的电子数为9NA | |
| B. | 300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA | |
| C. | 标准状况下,22.4LCH4气体与足量Cl2反应可生成NA个CH3Cl分子 | |
| D. | 80mL 10mol/L浓盐酸与足量MnO2反应,转移电子数为0.4NA |
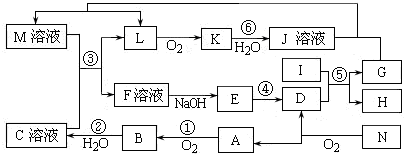
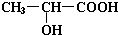 ;
;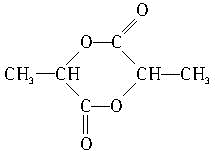 .
.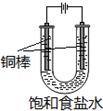 CuCl是应用广泛的有机合成催化剂,可采取不同方法制取.
CuCl是应用广泛的有机合成催化剂,可采取不同方法制取. [CuCl3]2-(无色溶液)逆向移动,生成CuCl.
[CuCl3]2-(无色溶液)逆向移动,生成CuCl.