题目内容
分别用一种试剂将下列物质中混入的少量杂质除去(括号内为混入的杂质)
| 物质 | 需加入的试剂 | 有关离子方程式 |
| (1)HNO3(H2SO4) | | |
| (2)Cu(Fe) | | |
| (3)NaCl(Na2CO3) | | |
Ba(NO3)2 Ba2++SO42-=BaSO4↓ HCl Fe+2H+=Fe2++H2↑ HCl 2H++CO32-=CO2↑+H2O
解析试题分析:①加入的试剂:硝酸钡.硝酸钡和稀硫酸反应生成硫酸钡沉淀和硝酸.化学方程式为:H2SO4+Ba(NO3)2═BaSO4↓+2HNO3
②加入的试剂:稀盐酸.盐酸能和铁反应,不能和铜反应.化学方程式为:Fe+2HCl═FeCl2+H2↑
④加入的试剂:稀盐酸.稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳.化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O
考点:物质除杂或净化的探究

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显变化。②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变。③若向溶液中加入BaCl2溶液,有白色沉淀生成试回答下列问题。
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是 。
(2)原溶液中含有的阳离子是 。
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为 。
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为 。
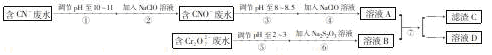
某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子.该厂拟定如图所示的废水处理流程。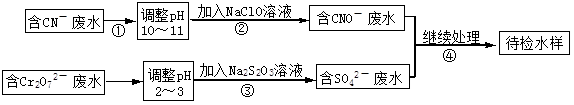 回答以下问题:
回答以下问题:
(1)步骤②发生反应的离子方程式可表示如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述离子方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为 (填选项标号)。
| A.1 | B.1/2 | C.2 | D.不能确定 |
③若反应中转移0.6mol电子,则生成的气体在标况下的体积是 。
(2)步骤③中反应时,每0.4molCr2O72-转移2.4mol的电子,该反应的离子方程式为 。
(3)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少. 请用离子方程式表示出现上述颜色变化的原因。
①产生蓝色沉淀的离子方程式为 ,②后又变黑色沉淀的离子方程式为 。
(4)铜是与人类关系非常密切的有色金属,已知常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生;2Cu+=" Cu+" Cu2+。大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH等。
①写出CuH在过量稀盐酸中有气体生成的离子方程式 。
②将CuH溶解在适量的稀硝酸中,完成下列反应的化学方程式:
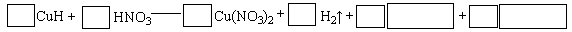
4.6g铜镁合金完全溶解于100mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到4480mLNO2和336 mLN2O4的混合气体(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液至离子恰好全部沉淀时,下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是46:69 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0mol·L-1 |
| C.产生沉淀8.51 g |
| D.离子恰好完全沉淀时,加入NaOH溶液的体积是230mL |
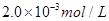 的硫代硫酸钠溶液10.0mL,恰好完全反应,判断反应完全的实验现象为____________________________________,则该加碘盐样品中碘元素的含量为______________________mg/Kg(用含w的代数式表示)。
的硫代硫酸钠溶液10.0mL,恰好完全反应,判断反应完全的实验现象为____________________________________,则该加碘盐样品中碘元素的含量为______________________mg/Kg(用含w的代数式表示)。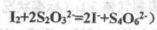 )
)