题目内容
Cr2O72-和CN-是工业废水中常见的污染物,若利用下列流程可对分别含两种离子的废水综合处理: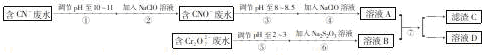
已知:Cr3+也有一定毒性,Cr3+在pH=6.0时开始沉淀,pH=8.0时沉淀完全。
回答下列问题:
(1)已知步骤②中无气体生成,写出反应的离子方程式 ,步骤④中NaClO可将CNO- 处理为完全无害的溶液,该过程中有两种无毒的不支持燃烧的气体产生,写出这两种气体的化学式 。
(2) 步骤⑥的反应为 S2O32-+ Cr2O72-+2H+→SO42-+ Cr3++H2O(未配平),每处理1mol Cr2O72-转移 mole-。
(3) 滤渣C的化学式为Cr(OH)3,溶液A和溶液B混合可使废水中的Cr3+沉淀的原因是 。
(4)步骤⑦的操作名称为 ,若该操作在实验室中进行,则所需的的玻璃仪器为 。
(1)CN-+ClO-===CNO-+Cl-(2分) N2、CO2(2分)
(2)6(1分)
(3)两溶液混合后pH≥8,故Cr3+完全沉淀(2分)
(4)过滤(1分) 漏斗、玻璃棒、烧杯(2分)
解析试题分析:
(1)步骤②中无气体生成,说明ClO-氧化CN-生成Cl-,故离子方程式为CN-+ClO-===CNO-+Cl-;步骤④中NaClO可将CNO-继续氧化,产物中的两种气体依据题意是N2和CO2,反应为2CNO-+3ClO-+H2O=N2↑+2CO2↑+3Cl-+2OH-。
(2) +6 +3
由Cr2O72- → 2Cr3+可知,每处理1mol Cr2O72-电子转移6mol
(3)溶液A、B混合后,pH达到Cr3+完全沉淀的范围,故Cr3+转化为Cr(OH)3[]
(4)步骤⑦为过滤
考点:考查化学实验操作、元素及其化合物性质。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、Al(OH)4-(或AlO2-) |
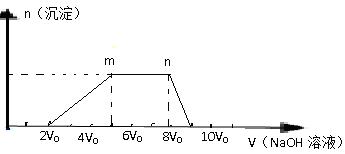
(1)该溶液中一定不存在的阳离子是 。
(2)该溶液中一定不存在的阴离子是 。
(3)m→n反应的的离子方程式为 。
(4)溶液中含有的阳离子对应的物质的量比为 。
Ⅱ、经检测,该溶液中还含有大量的Cl-、Br-、I-,向混合溶液中加入足量的氯化铁溶液,请写出有关反应的离子方程式 。
分别用一种试剂将下列物质中混入的少量杂质除去(括号内为混入的杂质)
| 物质 | 需加入的试剂 | 有关离子方程式 |
| (1)HNO3(H2SO4) | | |
| (2)Cu(Fe) | | |
| (3)NaCl(Na2CO3) | | |
已知在热的碱性溶液中,NaClO能发生如下反应:3NaClO=2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,则其最终产物是
| A.NaCl、NaClO | B.NaCl、NaClO3 | C.NaClO、NaClO3 | D.NaClO2、NaClO4 |
 4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①
4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①