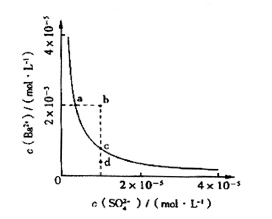
题目内容
加碘食盐中通常加入的是KIO3,该物质在酸性条件下表现出较强的氧化性,可以和碘化物、亚硫酸盐等还原性物质发生反应。
(1)写出KIO3与KI在稀硫酸介质中发生反应的离子方程式______________________
(2)为测定菜加碘盐中碘元素的含量,某学生甲设计了如下实验:
A.准确称取wg食盐,使其完全溶解在适量的蒸馏水中;
B.用稀硫酸酸化所得溶液,加入过量的KI溶液,使其充分反应;
C.以___________________为指示剂,运滴加入物质的量浓度为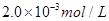 的硫代硫酸钠溶液10.0mL,恰好完全反应,判断反应完全的实验现象为____________________________________,则该加碘盐样品中碘元素的含量为______________________mg/Kg(用含w的代数式表示)。
的硫代硫酸钠溶液10.0mL,恰好完全反应,判断反应完全的实验现象为____________________________________,则该加碘盐样品中碘元素的含量为______________________mg/Kg(用含w的代数式表示)。
(已知: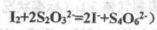 )
)
(3)某学生乙又进行了下列实验:
A.准确称取1.0g纯净的NaCl,加3mL蒸馏水配成溶液,溶液为无色;
B.滴入5滴指示剂和1mL 0.lmol/L Kl溶液,充分振荡,溶液不变化;
C.继续滴加l滴1mol/L的硫酸溶液,充分振荡,溶液变蓝色
推测实验中产生蓝色现象的原因,用离子方程式表示________________________
根据学生乙的实验结果,请对学生甲的实验结果进行分________________________(偏大、偏小、正确),其原因是________________________________________________.
⑴、IO3-+5I-+6H+=3I2+3H2O
⑵、淀粉溶液;溶液由蓝色变为无色,且三十秒内没有变化;1270/3w
⑶、4I-+4H++O2=2I2+2H2O;偏大;因为甲同学实验中加入了过量的KI,I-在稀硫酸环境中被空气中的氧气氧化生成了I2。
解析试题分析:⑴碘酸盐有强的氧化性,而碘离子有强的还原性,二都在酸性条件下可以发生氧化还原反应生成碘单质:IO3-+5I-+6H+=3I2+3H2O
⑵加碘食盐中加入硫酸和碘化钾后,形成碘单质,然后用有还原性的硫代硫酸钠来进行滴定,肯定是使用淀粉溶液来作指示剂了,因为淀粉指示剂不影响碘单质和硫代硫酸钠的用量。还能表明二者的反应刚好完全,所以判断反应完全的实验现象是:溶液由蓝色变为无色,且在三十秒内没有变化。
从以上提供的方程式中可知:
I KIO3
KIO3 3I2
3I2 6S2O32-
6S2O32-
127g 6mol
2.0×10-3mol/L×0.01L
x =2.0×10-5mol
则该加碘盐样品中碘元素的含量为:1000x×1000=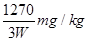
⑶因为原来加的是纯食盐,所以不含有碘酸钾,但是加入碘离子再加入酸后为什么还变色呢,肯定是有氧化剂,这个氧化剂只能是空气中的氧气。
考点:食盐中的成分以及碘元素的性质。

1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、Al(OH)4-(或AlO2-) |

(1)该溶液中一定不存在的阳离子是 。
(2)该溶液中一定不存在的阴离子是 。
(3)m→n反应的的离子方程式为 。
(4)溶液中含有的阳离子对应的物质的量比为 。
Ⅱ、经检测,该溶液中还含有大量的Cl-、Br-、I-,向混合溶液中加入足量的氯化铁溶液,请写出有关反应的离子方程式 。
分别用一种试剂将下列物质中混入的少量杂质除去(括号内为混入的杂质)
| 物质 | 需加入的试剂 | 有关离子方程式 |
| (1)HNO3(H2SO4) | | |
| (2)Cu(Fe) | | |
| (3)NaCl(Na2CO3) | | |
从海藻灰中可以提取碘的主要反应为:2 I-+Cl2="2" Cl-+I2,下列说法正确的是
| A.该反应属于置换反应 | B.I-具有氧化性 |
| C.1mol氯气转移了1mol电子 | D.Cl2是还原剂 |
 ,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作: 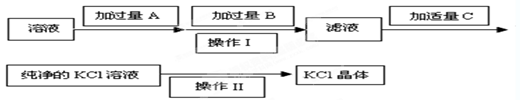
 、OH-、HCO
、OH-、HCO 、Cl-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
、Cl-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
 4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①
4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①