题目内容
【题目】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
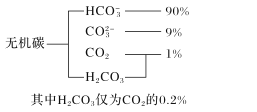
(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因______________________。已知春季海水pH=8.1,预测冬季海水碱性将会_______(填“增强”或“减弱”),理由是_________________。
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)===CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是________(填字母)。
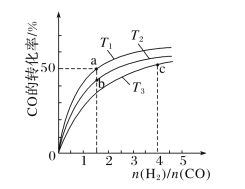
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:
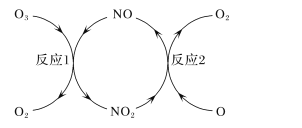
①NO的作用是_________________。
②已知:O3(g)+O(g)===2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)===NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1 。
反应2:热化学方程式为____________________________。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol -1,反应达到平衡时,N的体积分数随n(CO)n(NO)的变化曲线如下图。
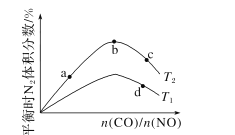
①b点时,平衡体系中C、N原子个数之比接近________。
②a、b、c三点CO的转化率从小到大的顺序为________;b、c、d三点的平衡常数从大到小的顺序为__________。
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,则NO的转化率为_____。
【答案】HCO3-+H2O=H2CO3+OH-; 减弱; 水解是吸热的,温度越低,水解程度越低; D; 催化剂; NO2(g)+O(g)=NO(g)+O2(g) △H=+57.2 kJ/mol; 1:1; c<b<a; b=c>d; 60%。
【解析】
(1)本小题考察盐类水解,水解平衡为吸热反应,冬天温度降低,水解平衡逆向移动,溶液碱性减弱;
(2)根据图中n(H2)/n(CO)越大,即增大氢气浓度,平衡正向移动,CO的转化率增大;根据图中关系,当n(H2)/n(CO)一定时,温度升高,CO转化率变大,反应正方向为吸热反应,与题意反应是放热反应像违背;利用反应平衡常数,在此基础上再加入反应物质,可求出Qc,比较Qc与K即可推断出平衡是否移动。
(3)通过图示,不难得到NO起着催化剂的作用,根据盖斯定律,可以得到反应2的热化学方程式;
(4)当反应物按化学计量数之比加入时,平衡时的N2的体积分数最大,所以b点的平衡体系中C、N原子个数比接近1:1;根据反应是放热反应,当n(CO)/n(NO)一定时,温度升高,平衡逆向移动,平衡常数变小,CO的转化率变小;列出三段式即可求出NO的转化率。
(1)海水呈弱碱性的主要原因是HCO3-+H2O=H2CO3+OH-;春季海水pH=8.1,水解平衡为吸热反应,冬天温度降低,水解平衡逆向移动,溶液碱性减弱;
(2) A.根据图中n(H2)/n(CO)越大,即增大氢气浓度,平衡正向移动,CO的转化率增大,而氢气转化率变小,图中CO转化率c>b,所以氢气转化率b>c;a、b两点的n(H2)/n(CO)相同,CO转化率越大,氢气的转化率越大,所以a>b。综上氢气的转化率为a>b>c;A项错误;
B.根据图中关系,当n(H2)/n(CO)一定时,温度升高,CO转化率变大,反应正方向为吸热反应,与题意反应是放热反应像违背;所以温度T1<T2<T3;B项错误;
C.c点状态下再通入1molCO和4molH2,等效平衡在原平衡的基础上压强增大一倍,正方向为气体体积减小的反应,故平衡正向移动,新平衡中H2的体积分数减小,C项错误;
D.T1温度下,a点n(H2)/n(CO)=1.5,列出三段式: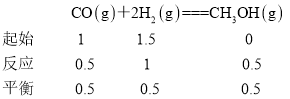 ,T1温度下的平衡常数K=
,T1温度下的平衡常数K=![]() =4,再通入0.5molCO和0.5molCH3OH,Qc=
=4,再通入0.5molCO和0.5molCH3OH,Qc=![]() =4,所以平衡不移动,D项正确;
=4,所以平衡不移动,D项正确;
(3)反应①是臭氧在NO作用下生成二氧化氮和氧气,二氧化氮在氧原子作用下生成NO和氧气,反应过程中NO参与反应后又生成,所以NO作用为催化剂;
根据盖斯定律两个热化学反应相减可得到反应2的热化学方程式:NO2(g)+O(g)=NO(g)+O2(g) △H=+57.2kJ/mol;
(4)①当反应物按化学计量数之比加入时,平衡时的N2的体积分数最大,所以b点的平衡体系中C、N原子个数比接近1:1;
②增大n(CO)/n(NO),CO转化率降低,所以a、b、c三点CO的转化率从小到大的顺序为c<b<a;平衡常数只与温度有关,所以b、c点的平衡常数相同,反应放热,升温平衡正向移动,N2的体积分数减小,所以T1>T2,d点平衡常数小于b、c点,所以b、c、d三点的平衡常数从大到小的顺序为b=c>d;
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,令平衡时CO转化了xmol,列出三段式: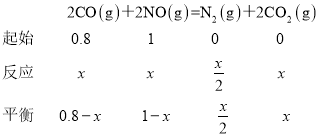 ,N的体积分数为
,N的体积分数为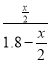 =20%,解得x=0.6,所以CO转化率为0.6/1=60%。
=20%,解得x=0.6,所以CO转化率为0.6/1=60%。

【题目】常温下,将某一元酸 HA 和 NaOH 溶液等体积混合,两种溶液的浓度和混合后所得溶液的 pH 如表:
实验编号 | HA物质的量浓度/(molL-1) | NaOH物质的量浓度/( molL-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.2 | pH=a |
请回答:
(1)用离子方程式表示①组混合溶液显碱性的原因是_____。
(2)②组中c_____0.2(填“>”、“<”或“=”,下同);③组中 a_____9。
(3)常温下,HA 的电离平衡常数的值为_____。
(4)从以上实验分析,将 pH=11 的 NaOH 溶液与 pH=3 的 HA 溶液等体积混合,所得混合溶液中所有离子浓度由大到小的顺序为_____。