题目内容
【题目】磷酸是重要的化学试剂和工业原料。请回答下列问题:
(1)已知:25°C时,磷酸和碳酸的电离常数如下表所示。

向Na2CO3溶液中滴加少量H3PO4溶液,反应的离子方程式为__。
(2)已知:
I.CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) H= -271kJ·mol-1
II.5CaO(s)+3H3PO4(l)+HF(g)=Ca3(PO4)3F(s)+5H2O(l) H=-937 kJ·mol-1
回答下列问题:
①工业上用Ca3(PO4)3F和硫酸反应制备磷酸的热化学方程式为__。
②一定条件下,在密闭容器中只发生反应II,达到平衡后缩小容器容积,HF的平衡转化率__(填“增大”“减小”或“不变”,下同);HF的平衡浓度__。
(3)工业上用磷尾矿制备Ca3(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g)=CO2(g)+H2(g) H。
①一定温度下,向10L密闭容器中充入0.5molCO和lmolH2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02mol·L-1·min-1。则CO的平衡转化率a=__,该反应的平衡常数K=__。
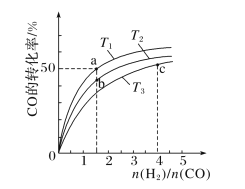
②在压强不变的密闭容器中发生上述反应,设起始的![]() =y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的H__0(填“>”“<”或“=”,下同)。a_1,理由为__。
=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的H__0(填“>”“<”或“=”,下同)。a_1,理由为__。

【答案】H3PO4+2CO32-= 2HCO3-+HPO42- Ca5(PO4)3F(s)+5H2SO4(l)![]() 3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418 kJ·mol-1 增大 不变 80%
3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418 kJ·mol-1 增大 不变 80% ![]() < < 相同温度下,y越小,CO 的转化率越大,其平衡体积分数越小
< < 相同温度下,y越小,CO 的转化率越大,其平衡体积分数越小
【解析】
根据电离平衡常数可知酸性有如下关系:H3PO4﹥H2CO3﹥H2PO4-﹥HCO3-﹥HPO42-,少量H3PO4和CO32-不能生成二氧化碳和水,只能生成HCO3-,由于H2PO4-﹥HCO3-,H2PO4-也能和CO32-反应,所以另一个产物为HPO42-。
(1)根据电离平衡常数可知酸性有如下关系:H3PO4﹥H2CO3﹥H2PO4-﹥HCO3-﹥HPO42-,所以少量磷酸和碳酸钠反应的最终产物为:NaHCO3和NaHPO4,所以离子方程式为:H3PO4+2CO32-= 2HCO3-+HPO42-,故答案为:H3PO4+2CO32-= 2HCO3-+HPO42-;
(2)①已知:Ⅰ.CaO(s)+H2SO4(l)![]() CaSO4(s)+H2O(l) ΔH=-271 kJ·mol-1
CaSO4(s)+H2O(l) ΔH=-271 kJ·mol-1
Ⅱ.5CaO(s)+3H3PO4(l)+HF(g)![]() Ca5(PO4)3F(s)+5H2O(l)ΔH=-937 kJ·mol-1
Ca5(PO4)3F(s)+5H2O(l)ΔH=-937 kJ·mol-1
根据盖斯定律可知Ⅰ×5-Ⅱ即得到Ca5(PO4)3F和硫酸,所以反应制备磷酸的热化学方程式为Ca5(PO4)3F(s)+5H2SO4(l)![]() 3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418 kJ·mol-1,故答案为:Ca5(PO4)3F(s)+5H2SO4(l)
3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418 kJ·mol-1,故答案为:Ca5(PO4)3F(s)+5H2SO4(l)![]() 3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418 kJ·mol-1;
3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418 kJ·mol-1;
②反应Ⅱ的正反应体积减小,所以达到平衡后缩小容器容积平衡向正反应方向移动,HF的平衡转化率增大。由于温度不变,平衡常数不变,即K=c(HF),因此HF的平衡浓度不变,故答案为:增大;不变;
(3)①测得 0~2 min内用CO2表示的反应速率v(CO2)=0.02 mol·L-1·min-1,所以生成CO2浓度是0.04mol/L,则 ,因此CO的平衡转化率α=
,因此CO的平衡转化率α=![]() ×100%=80%,该反应的平衡常数 K=
×100%=80%,该反应的平衡常数 K=![]() =
=![]() ,故答案为:80%;
,故答案为:80%;![]() ;
;
②根据图像可知升高温度CO的体积分数增大,说明平衡向正反应方向进行,所以该反应的 ΔH<0,由于相同温度下,y越小,CO 的转化率越大,其平衡体积分数越小,所以a<1,故答案为:<;<;相同温度下,y越小,CO 的转化率越大,其平衡体积分数越小。

【题目】利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
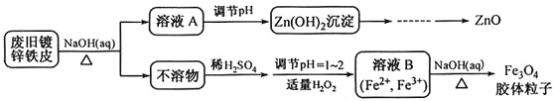
已知:Zn及化合物的性质与Al及化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧锌铁皮的作用有_________________________________________。
A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化 |
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是______________。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,原因是___________________。
(4)Fe3O4胶体粒子能否用减压过滤发实现固液分离?____________(填“能”或“不能”),理由是_________________________________________________。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取_______g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。
配制该标准溶液时,下列仪器中不必要用到的有_____________。(用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(6)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将__________(填“偏大”、“偏小”或“不变”)。
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。

有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。