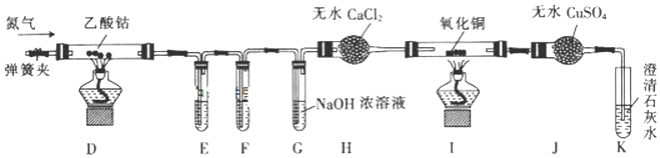
题目内容
【题目】下列离子方程式正确的是( )
A.将Ca(HCO3)2溶液与少量Ca(OH)2溶液混合:Ca2+ +OH + HCO3 = CaCO3↓+ H2O
B.向Ba(NO3)2溶液中通入SO2气体,出现白色沉淀:SO2+H2O+Ba2+ = BaSO3↓+ 2H+
C.碳酸钙溶于醋酸:CaCO3 + 2H+ = Ca2+ + CO2↑+ H2O
D.往苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O2
+CO2+H2O2![]() +CO32
+CO32
【答案】A
【解析】
A选项,将Ca(HCO3)2溶液与少量Ca(OH)2溶液混合,少的定为1mol,1mol Ca(OH)2电离出2mol氢氧根和1mol钙离子,2mol氢氧根消耗2mol碳酸氢根反应生成2mol碳酸根,和2mol钙离子反应生成2mol碳酸钙,因此Ca2+ +OH + HCO3 = CaCO3↓+ H2O,故A正确;
B选项,向Ba(NO3)2溶液中通入SO2气体,出现白色沉淀,二氧化硫被硝酸根氧化生成硫酸钡,故B错误;
C选项,醋酸是弱酸,不能拆,故C错误;
D选项,往苯酚钠溶液中通入少量CO2只能生成碳酸氢根,![]() +CO2+H2O2
+CO2+H2O2![]() +HCO3,故D错误。
+HCO3,故D错误。
综上所述,答案为A。

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目