题目内容
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:![]() ,一种工业合成氨,进而合成尿素的简易流程图如下:
,一种工业合成氨,进而合成尿素的简易流程图如下:

(1)步骤II中制氢气原理如下:
![]()
![]()
恒容容器中,对于以上反应,能加快反应速率的是______.
![]() 升高温度
升高温度![]() 充入He
充入He![]() 加入催化剂
加入催化剂![]() 降低压强
降低压强
(2)天然气中的![]() 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为![]() ,一定条件下向
,一定条件下向![]() 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为______.
溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为______.
(3)![]() 和
和![]() 在高温、高压、催化剂条件下可合成
在高温、高压、催化剂条件下可合成![]() ,反应的化学方程式______
,反应的化学方程式______![]() 以
以![]() 、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:______.
、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:______.
(4)已知![]()
![]() ,若合成尿素的流程中转化率为
,若合成尿素的流程中转化率为![]() 时,100吨甲烷为原料能够合成______吨尿素.
时,100吨甲烷为原料能够合成______吨尿素.
【答案】ac 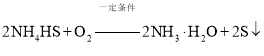

![]() 400
400
【解析】
(1)根据影响化学反应速率的因素判断,一般增大浓度、增大压强、升高温度,反应的反应速率增大;
(2)根据元素守恒和电子得失守恒写出化学方程式;
(3)根据元素守恒及题中的反应物和生成物写出化学方程式,在CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池中,负极上CH3CH2OH失去电子,发生氧化反应,可写出电极反应式;
(4)根据化学方程式,利用元素守恒,可计算出尿素的质量。
(1)根据影响化学反应速率的因素可知,升高温度和加入催化剂都可以增加反应速率,充入氦气各物质的浓度没变,所以反应速率不变,减小压强反应速率减小,故答案为:ac;
(2)根据元素守恒及题中的反应物和生成物可知化学方程式为: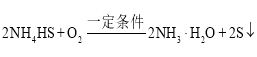 ,故答案为:
,故答案为: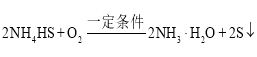 ;
;
(3)根据元素守恒及题中的反应物和生成物写出化学方程式为: ,在CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池中,负极上CH3CH2OH失去电子,发生氧化反应,可写出电极反应式为
,在CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池中,负极上CH3CH2OH失去电子,发生氧化反应,可写出电极反应式为![]() ,故答案为:
,故答案为: ;
;![]() ;
;
(4) 根据元素守恒及题中的反(5)根据化学方程式CH4(g)+H2O(g)CO(g)+3H2(g) 和 CO(g)+H2O(g)CO2(g)+H2(g),![]() ,及元素守恒可知
,及元素守恒可知![]() ,
,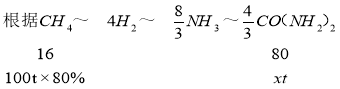 ,
,![]() ,故答案为:400t。
,故答案为:400t。

【题目】实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
实验编号 试剂 | A | B | C |
10% H2O2/mL | 20.0 | V1 | V2 |
2 mol·L-1 FeCl3/ mL | 0 | 5.0 | 10.0 |
H2O/ mL | V3 | V4 | 0 |
按要求回答下列问题:
(1)欲用图装置来比较该反应的反应速率快慢,检查该装置气密性的方法是_______。

(2)当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测____________________推(计)算反应速率。
(3)为实现实验目的,则V4=____。
(4)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3+ + H2O2 =2Fe2+ + O2↑+ 2H+,则第二步反应的离子方程式为:___________________。
(5)读数时发现,量气装置左端液面低于右端液面,则测得的气体体积_____填“偏大”、“偏小”或“无影响”)