题目内容
(8分)有Fe和Fe2O3混合物溶于500 mL稀HNO3中,放出2.24 L NO(标准状况),并剩余5.44 g Fe。向反应后的溶液中通入2.016 L Cl2(标准状况),恰好能使溶液中Fe2+全部氧化。求:
(1)稀HNO3物质的量浓度。
(2)混合物中的Fe的质量分数。
(1)稀HNO3物质的量浓度。
(2)混合物中的Fe的质量分数。
(1)0.92 mol·L-1 (2)89.99%
Fe有剩余,说明稀HNO3量不足,且Fe3+在溶液中一定不存在。溶液中Fe和Fe2O3的存在方式均为Fe(NO3)2。2.016 L÷22.4 L·mol-1="0.09" mol,溶液中铁元素共0.09×2="0.18" mol。在此过程中分析氧化剂和还原剂,由于Fe2O3生成的Fe3+先得Fe单质的电子,又生成Fe2+失电子给Cl2,故整个过程可以看作没有得电子也没有失电子,则该过程中实际转移电子数为:2.24÷22.4×3+0.09×2="0.48" mol,只相当于氧化单质铁,故原混合物中溶解铁为:0.48 mol÷3="0.16" mol,所有的铁再加上剩余的铁。同样硝酸分为作酸和作氧化剂的硝酸。由Fe(NO3)2 0.18 mol求作酸的硝酸,由NO 0.1 mol求作氧化剂的硝酸,两部分相加便是所有的硝酸的量。混合物中Fe2O3同样用所有溶液中铁元素0.18 mol减去溶解的铁单质可求得,再求Fe的含量。
解:(1)Cl2的物质的量:2.016 L÷22.4 L·mol-1="0.09" mol,溶液中Fe(NO3)2物质的量0.09 L·mol-1×2="0.18" mol(铁有剩余,没有Fe3+),作酸的硝酸为:0.18 mol×2="0.36" mol作氧化剂的硝酸为: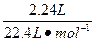 ="0.1" mol
="0.1" mol
c(HNO3)= ="0.92" mol·L-1
="0.92" mol·L-1
(2)由(1)已知溶液中的铁元素共有0.09×2="0.18" mol,由于Fe2O3生成的Fe3+先得铁单质的电子生成Fe2+,又失电子给Cl2,故整个过程可以看作没有得电子也没有失电子,则该过程中实际转移电子数为2.24 L÷22.4 L·mol-1×3+0.09 mol×2="0.48" mol,只相当于氧化铁单质,故原混合物溶解铁为:0.48 mol÷3="0.16" mol,所有的单质铁为:0.16 mol+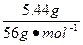 ="0.257" mol
="0.257" mol
Fe2O3中 Fe元素的物质的量:0.18 mol-0.16 mol="0.02" mol。
所以Fe2O3的物质的量为0.01 mol。
Fe的质量分数为:
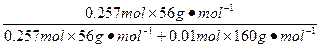 ×100%=89.99%。
×100%=89.99%。
解:(1)Cl2的物质的量:2.016 L÷22.4 L·mol-1="0.09" mol,溶液中Fe(NO3)2物质的量0.09 L·mol-1×2="0.18" mol(铁有剩余,没有Fe3+),作酸的硝酸为:0.18 mol×2="0.36" mol作氧化剂的硝酸为:
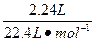 ="0.1" mol
="0.1" molc(HNO3)=
 ="0.92" mol·L-1
="0.92" mol·L-1(2)由(1)已知溶液中的铁元素共有0.09×2="0.18" mol,由于Fe2O3生成的Fe3+先得铁单质的电子生成Fe2+,又失电子给Cl2,故整个过程可以看作没有得电子也没有失电子,则该过程中实际转移电子数为2.24 L÷22.4 L·mol-1×3+0.09 mol×2="0.48" mol,只相当于氧化铁单质,故原混合物溶解铁为:0.48 mol÷3="0.16" mol,所有的单质铁为:0.16 mol+
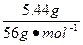 ="0.257" mol
="0.257" molFe2O3中 Fe元素的物质的量:0.18 mol-0.16 mol="0.02" mol。
所以Fe2O3的物质的量为0.01 mol。
Fe的质量分数为:
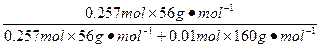 ×100%=89.99%。
×100%=89.99%。
练习册系列答案
相关题目
 的物质的量浓度之比为( )
的物质的量浓度之比为( )