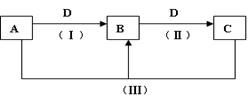
题目内容
在200mLFeCl3和FeCl2的混合溶液中,加入0.01 mol铁粉恰好完全反应,溶液中无Fe3+,取反应后溶液的与Cl2反应,溶液中Fe2+有80%被氧化成Fe3+,向通入Cl2后的溶液中再滴入AgNO3溶液,产生白色沉淀0.028 mol,求原溶液中FeCl3和FeCl2的物质的量浓度各多少?
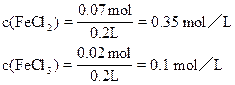
2FeCl3 + Fe = 3FeCl2; 2FeCl2+Cl2=2FeCl3
0.01 0.03
设:溶液中FeCl2为x,FeCl2中未氧化的有0.2 x,FeCl2中被氧化
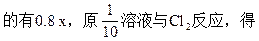
0.2×2x+0.8×3x="0.28" mol x="0.01" mol
原FeCl2=0.01×10-0.03="0.07" mol

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目