题目内容
12.氯水既可以用来杀菌消毒,又可作漂白剂,其中起作用的物质是( )| A. | Cl2 | B. | HCl | C. | HClO | D. | H2O |
分析 氯气(Cl2)可以和水反应得到HCl和HClO(次氯酸),HClO具有强氧化性和漂白性,以此解答该题.
解答 解:氯气与水可以反应生成具有强氧化性的HClO,具有漂白性,还可杀菌消毒作用,氯气、HCl不具有漂白性,故选C.
点评 本题考查氯气的性质,为高频考点,侧重于化学与生活、生产的考查,注意氯气和水生成的次氯酸具有氧化性是解题的关键,难度不大.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
2. CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点.铊的相关信息如图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子.下列有关卡片信息解读不正确的是( )
CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点.铊的相关信息如图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子.下列有关卡片信息解读不正确的是( )
 CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点.铊的相关信息如图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子.下列有关卡片信息解读不正确的是( )
CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点.铊的相关信息如图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子.下列有关卡片信息解读不正确的是( )| A. | 铊的元素符号为Tl | B. | 铊原子的中子数=204-81=123 | ||
| C. | 铊位于第六周期ⅢA族 | D. | 铊的金属性比铝的金属性强 |
3.下列说法正确的是( )
| A. | 硫酸、纯碱、偏铝酸钠和过氧化钠分别属于酸、碱、盐和氧化物 | |
| B. | 乙醇、次氯酸钠和二氧化硫分别属于非电解质、强电解质和弱电解质 | |
| C. | Na、Al、Cu通常分别用电解法、热分解法和置换法冶炼得到 | |
| D. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 |
20. 某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:
某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:
请回答下列问题:
(1)写出NaHCO3和盐酸发生反应的离子方程式HCO3-+H+=CO2↑+H2O
(2)由上述实验得出的结论是:Na2CO3溶液与盐酸的反应是放热(填“吸热”或“放热”下同)反应,NaHCO3溶液与盐酸反应是吸热反应
(3)在如图中画出Na2CO3和盐酸反应前后能量变化曲线(标注“反应物总能量”和“生成物总能量”)
 某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:
某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:| 序号 | 35mL试剂 | 固体 | 混合温度前/℃ | 混合温度后/℃ |
| ① | 水 | 2.5gNaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2gNa2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5gNaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2gNa2CO3 | 20.0 | 25.1 |
(1)写出NaHCO3和盐酸发生反应的离子方程式HCO3-+H+=CO2↑+H2O
(2)由上述实验得出的结论是:Na2CO3溶液与盐酸的反应是放热(填“吸热”或“放热”下同)反应,NaHCO3溶液与盐酸反应是吸热反应
(3)在如图中画出Na2CO3和盐酸反应前后能量变化曲线(标注“反应物总能量”和“生成物总能量”)
17.下列物质中既能与稀盐酸反应,又能与氢氧化钠溶液反应产生氢气的是( )
| A. | CuO | B. | H2SO4 | C. | CuSO4 | D. | Al |
1.废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收 Cu并制备ZnO的部分实验过程如下:
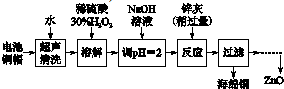
(1)①铜帽溶解时加入H2O2的目的是Cu+H2O2+H2SO4=CuSO4+2H2O (用化学方程式表示).
②铜帽溶解完全后,需将溶液中过量的H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2 2S2O+I2═2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象蓝色褪去且30秒不恢复蓝色.
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会偏高(填“偏高”、“偏低”或“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
实验中可选用的试剂:30% H2O2、1.0mol•L-1 HNO3、1.0mol•L-1 NaOH.
由除去铜的滤液制备ZnO的正确实验步骤依次为:⑤④①②③⑥
①过滤;
②调节溶液pH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;
③过滤、洗涤、干燥;
④调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
⑤向滤液中加入适量30% H2O2,使其充分反应;
⑥900℃煅烧;
(4)Zn(OH)2的溶度积常数为1.2×10-17(mol•L-1)3,当Zn2+沉淀完全时,此时溶液中Zn2+的浓度为1.2×10-7 mol•L-1.

(1)①铜帽溶解时加入H2O2的目的是Cu+H2O2+H2SO4=CuSO4+2H2O (用化学方程式表示).
②铜帽溶解完全后,需将溶液中过量的H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2 2S2O+I2═2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象蓝色褪去且30秒不恢复蓝色.
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会偏高(填“偏高”、“偏低”或“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 9 |
由除去铜的滤液制备ZnO的正确实验步骤依次为:⑤④①②③⑥
①过滤;
②调节溶液pH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;
③过滤、洗涤、干燥;
④调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
⑤向滤液中加入适量30% H2O2,使其充分反应;
⑥900℃煅烧;
(4)Zn(OH)2的溶度积常数为1.2×10-17(mol•L-1)3,当Zn2+沉淀完全时,此时溶液中Zn2+的浓度为1.2×10-7 mol•L-1.
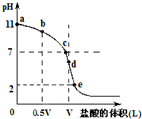 常温时向浓度为0.1mol/L体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
常温时向浓度为0.1mol/L体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题: