题目内容
4.(1)下列六种生活中常见物质:①食盐 ②食用油 ③青霉素 ④鸡蛋 ⑤西红柿 ⑥塑料
按要求用物质序号填空:
作调味剂的是①
作抗生素的是③
富含蛋白质的是④
富含维生素的是⑤
富含油脂的是②
属于合成材料的是⑥
(2)一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
Ⅰ.在人体中进行Fe2+$?_{②}^{①}$Fe3+的转化时,①中的Fe2+作还原剂(填“氧化剂”、“还原剂”),②中的Fe3+作氧化剂(填“氧化剂”、“还原剂”)
Ⅱ.“服用维生素C,可使食物中的Fe3+还原成Fe2+这句话指出,维生素C在这一反应中作还原剂(填“氧化剂”、“还原剂”)
Ⅲ.市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(HCl)的作用下转化成亚铁盐.此反应的离子方程式为Fe+2H+═Fe2++H2↑.
分析 (1)①食盐有咸味;③青霉素是抗生素;④鸡蛋富含蛋白质;⑤西红柿富含维生素;②食用油富含油脂;⑥塑料是合成材料;
(2)Ⅰ.元素的化合价升高,作还原剂,元素的化合价降低,作氧化剂;
Ⅱ.维生素C,可使食物中的Fe3+还原成Fe2+,Fe元素的化合价降低,作氧化剂;
Ⅲ.铁与盐酸反应生成氯化亚铁和氢气.
解答 解:(1)①食盐有咸味,可做调味剂;②食用油富含油脂;③青霉素是抗生素;④鸡蛋富含蛋白质;⑤西红柿富含维生素⑥塑料是人工合成材料,故答案为:①;③;④;⑤;②;⑥;
(2)Ⅰ.Fe2+→Fe3+的转化时,元素的化合价升高,作还原剂;Fe3+→Fe2+转化时,元素的化合价降低,作氧化剂,
故答案为:还原剂;氧化剂;
Ⅱ.维生素C,可使食物中的Fe3+还原成Fe2+,Fe元素的化合价降低,作氧化剂,则维生素C具有还原性,作还原剂,故答案为:还原剂;
Ⅲ.铁粉在人体胃酸(主要成分时盐酸)的作用下转化成亚铁盐的离子方程式为:Fe+2H+═Fe2++H2↑,故答案为:Fe+2H+═Fe2++H2↑.
点评 本题考查营养素以及氧化还原反应,明确氧化还原反应中元素的化合价变化是解答本题的关键,并熟悉氧化还原反应中的概念来解答,题目难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
14.已知阴离子R2-的原子核内有n个中子,R原子的质量数为m,则w gR2-所含有电子的物质的量是( )
| A. | $\frac{m-n-2}{w•m}$ mol | B. | $\frac{w?m-n?}{n}$mol | C. | $\frac{w}{m}$(m-n-2)mol | D. | $\frac{w}{m}$(m-n+2)mol |
12.氯水既可以用来杀菌消毒,又可作漂白剂,其中起作用的物质是( )
| A. | Cl2 | B. | HCl | C. | HClO | D. | H2O |
9.实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 pH=5时沉淀完全).其中分析错误的是( )
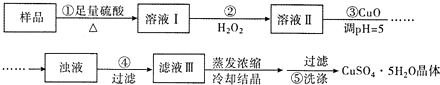

| A. | 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| B. | 步骤②可用氯水、硝酸等强氧化剂代替H2O2 | |
| C. | 步骤③用 CuCO3代替CuO也可调节溶液的pH | |
| D. | 步骤⑤的操作为:向漏斗中加人少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次 |
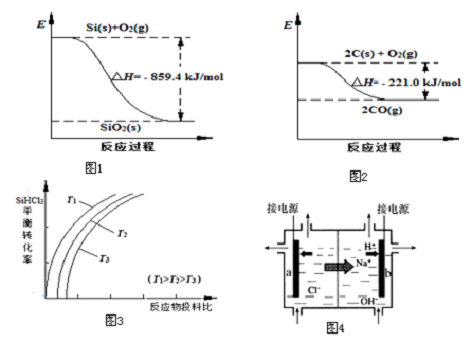
16.高纯晶体硅是信息技术的关键材料.
(1)工业上用石英砂和焦炭可制得粗硅.已知:图1、图2请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+638.4 kJ•mol-1
(2)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:C和Si最外层电子数相同,C原子半径小于Si.
(3)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅.
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,
可用蒸馏(或分馏)方法提纯SiHCl3.
②用SiHCl3制备高纯硅的反应为SiHCl3(g)+H2(g)?Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图3所示.
下列说法正确的是ac(填字母序号).
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是n(SiHCl3)/n( H2)
c.实际生产中为提高SiHCl3的利用率,应适当升高温度
③上述生产过程所需氯气和氢气均由氯碱厂提供,氯碱厂的基本设备是离子交换膜电解槽(如图4所示),其中进入阳极室的溶液是精制的饱和食盐水,b电极上的电极反应式是2H++2e-═H2↑.
(4)二氧化硅大量用于生产玻璃.工业上用SiO2、Na2CO3和CaCO3共283kg在高温下完全反应时放出CO2 44kg,生产出的玻璃可用化学式Na2SiO3•CaSiO3•xSiO2表示,则其中x=4.
(1)工业上用石英砂和焦炭可制得粗硅.已知:图1、图2请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+638.4 kJ•mol-1
(2)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:C和Si最外层电子数相同,C原子半径小于Si.
(3)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅.
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,
可用蒸馏(或分馏)方法提纯SiHCl3.
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
下列说法正确的是ac(填字母序号).
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是n(SiHCl3)/n( H2)
c.实际生产中为提高SiHCl3的利用率,应适当升高温度
③上述生产过程所需氯气和氢气均由氯碱厂提供,氯碱厂的基本设备是离子交换膜电解槽(如图4所示),其中进入阳极室的溶液是精制的饱和食盐水,b电极上的电极反应式是2H++2e-═H2↑.
(4)二氧化硅大量用于生产玻璃.工业上用SiO2、Na2CO3和CaCO3共283kg在高温下完全反应时放出CO2 44kg,生产出的玻璃可用化学式Na2SiO3•CaSiO3•xSiO2表示,则其中x=4.

13.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0mol•L-1NaClO溶液中:Fe2+、K+、I-、Cl- | |
| B. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| C. | 0.1 mol•L-1NaAlO2 溶液:H+、Na+、Cl-、SO42- | |
| D. | 由水电离出的c(OH-)=1×10-12mol•L-1的溶液中:NH4+、HCO3-、Na+、Cl- |
14.用下列实验装置完成对应的实验(部分仪器已略去),能达到实验目的是( )
| A. |  称取NaOH固体 | B. | 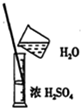 稀释浓硫酸 | ||
| C. | 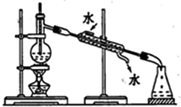 分离乙醇和水混合物 | D. | 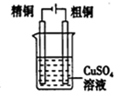 电解炼制铜 |
