题目内容
1.废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收 Cu并制备ZnO的部分实验过程如下: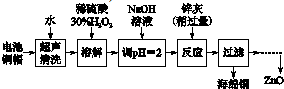
(1)①铜帽溶解时加入H2O2的目的是Cu+H2O2+H2SO4=CuSO4+2H2O (用化学方程式表示).
②铜帽溶解完全后,需将溶液中过量的H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2 2S2O+I2═2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象蓝色褪去且30秒不恢复蓝色.
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会偏高(填“偏高”、“偏低”或“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 9 |
由除去铜的滤液制备ZnO的正确实验步骤依次为:⑤④①②③⑥
①过滤;
②调节溶液pH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;
③过滤、洗涤、干燥;
④调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
⑤向滤液中加入适量30% H2O2,使其充分反应;
⑥900℃煅烧;
(4)Zn(OH)2的溶度积常数为1.2×10-17(mol•L-1)3,当Zn2+沉淀完全时,此时溶液中Zn2+的浓度为1.2×10-7 mol•L-1.
分析 利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收 Cu并制备ZnO,电池铜帽加入水过滤后除去溶于水的杂质,在固体中加入过氧化氢溶解,铜生成硫酸铜溶液,加热煮沸将溶液中过量的H2O2除去,加入氢氧化钠溶液调节溶液PH=2沉淀铁离子,加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物),反应过滤得到海绵铜,沉淀锌离子得到氢氧化锌,分解得到氧化锌;
(1)①酸性条件下Cu与过氧化氢发生氧化还原反应生成硫酸铜和水;
②过氧化氢加热到153℃便猛烈的分解;
(2)①根据淀粉与碘单质作用变蓝解答;
②根据H2O2+2I-+2H+=I2+2H2O解答;
(3)滴加H2O2溶液,使Fe2+转化完全为Fe3+,滴加NaOH溶液,形成氢氧化铁沉淀,除杂后形成氢氧化锌沉淀,过滤、洗涤、干燥900℃煅烧制得氧化锌;
(4)Ksp=c(Zn2+)•c2(OH-)来计算离子浓度.
解答 解:(1)①因为双氧水在酸性溶液中先把铜氧化成氧化铜,当然这是一个微弱的反应,形成一个平衡,但是形成的氧化铜马上就会被稀硫酸溶解,平衡被打破,反应朝正方向进行,故而逐渐溶解,反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;
故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;
②过氧化氢性质比较稳定,若加热到153℃便猛烈的分解为水和氧气,将溶液中过量的H2O2 除去可加热至沸,
故答案为:加热至沸;
(2)①淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,半分钟颜色不变,说明滴定到达终点,
故答案为:淀粉溶液;蓝色褪去且30秒不恢复蓝色;
②若留有H2O2,加入KI后,会有以下反应:H2O2+2I-+2H+=I2+2H2O误当成2Cu2++4I-=2CuI(白色)↓+I2 生成的碘,使测定结果偏高,
故答案为:偏高;
(3)①向滤液中加入30%H2O2,使其充分反应,目的使Fe2+转化完全为Fe3+,滴加NaOH溶液,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全,向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全,900℃煅烧,制得氧化锌,由除去铜的滤液制备ZnO的正确实验步骤依次为:⑤④①②③⑥;
故答案为:⑤④①②③⑥;
(4)常温下Ksp[Zn(OH)2]=1.2×10-17,Ksp=c(Zn2+)•c2(OH-),调至pH=9即氢氧根离子浓度为10-5mol/L,使溶液中的Zn2+完全转化为Zn(OH)2沉淀,此时溶液中的c(Zn2+)=$\frac{Ksp}{{c}^{2}(O{H}^{-})}$=$\frac{1.2×1{0}^{-17}}{1{0}^{-10}}$=1.2×10-7mol/L,故答案为:1.2×10-7 mol•L-1.
点评 本题主要考查实验室废弃旧电池的铜帽回收铜和制备ZnO,考查学生对综合实验处理能力,注意实验方案的设计原理和步骤是解答的关键,平时注意打好扎实的基础知识和灵活应用知识解决问题的能力培养,题目难度中等.

(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:
CO2 (g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g) 的△H=+247.3 kJ•mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①在不同温度下催化剂的催化效率与乙酸的生成速率如图1所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低
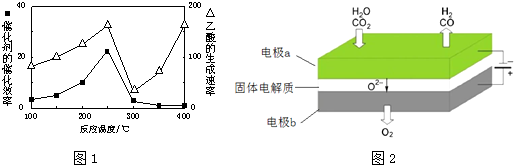
②为了提高该反应中CH4的转化率,可以采取的措施是增大体积减小压强或增大CO2的浓度
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O
(3)Li2O、Na2O、MgO均能吸收CO2.①如果寻找吸收CO2的其他物质,下列建议合理的是ab
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品.
反应A:CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO+H2+O2高温电解技术能高效实现反应A,工作原理示意图2如下:CO2在电极a放电的反应式是CO2+2e-═CO+O2-.
| A. | Cl2 | B. | HCl | C. | HClO | D. | H2O |
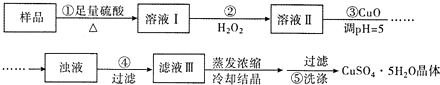
| A. | 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| B. | 步骤②可用氯水、硝酸等强氧化剂代替H2O2 | |
| C. | 步骤③用 CuCO3代替CuO也可调节溶液的pH | |
| D. | 步骤⑤的操作为:向漏斗中加人少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次 |
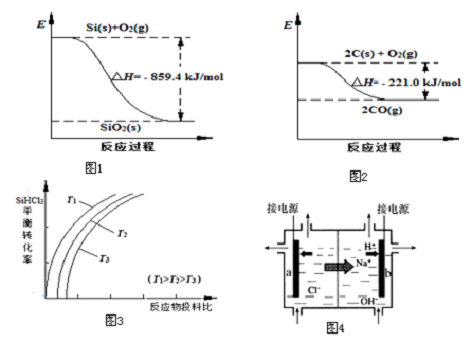
(1)工业上用石英砂和焦炭可制得粗硅.已知:图1、图2请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+638.4 kJ•mol-1
(2)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:C和Si最外层电子数相同,C原子半径小于Si.
(3)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅.
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,
可用蒸馏(或分馏)方法提纯SiHCl3.
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
下列说法正确的是ac(填字母序号).
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是n(SiHCl3)/n( H2)
c.实际生产中为提高SiHCl3的利用率,应适当升高温度
③上述生产过程所需氯气和氢气均由氯碱厂提供,氯碱厂的基本设备是离子交换膜电解槽(如图4所示),其中进入阳极室的溶液是精制的饱和食盐水,b电极上的电极反应式是2H++2e-═H2↑.
(4)二氧化硅大量用于生产玻璃.工业上用SiO2、Na2CO3和CaCO3共283kg在高温下完全反应时放出CO2 44kg,生产出的玻璃可用化学式Na2SiO3•CaSiO3•xSiO2表示,则其中x=4.
Ⅰ.用Ⅰ1、Ⅰ2、Ⅰ3、Ⅰ4表示钪的电离能,其数据如图1.
(1)与钪同周期且含有相同未成对电子数的非金属元素为Br(填元素符号).
(2)$\frac{{I}_{2}}{{I}_{1}}$<$\frac{{I}_{4}}{{I}_{3}}$(填“>”或“<”).
(3)氯化钠晶体熔点高于氯化钾,其原因为钠离子半径小于钾离子,氯化钠晶格能大于氯化钾,所以氯化钠熔点高.
Ⅱ.提钪工艺中常用草酸法精制,草酸钪络盐的热重数据如下表:
| 草酸钪络盐 | 温度区间(K) | 质量(g) |
| Sc2(C2O4)3•6H2O | 298 | 0.462 |
| 383~423 | 0.372 | |
| 463~508 | 0.354 | |
| 583~873 | 0.138 |
(5)按草酸钪络盐失水时所克服的作用力大小不同,Sc2(C2O4)3•6H2O中的水分子可以分为2种.
(6)Sc2(C2O4)3•6H2O从583K加热到873K,断裂的化学键类型为离子键、共价键.
| A. | 1.0mol•L-1NaClO溶液中:Fe2+、K+、I-、Cl- | |
| B. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| C. | 0.1 mol•L-1NaAlO2 溶液:H+、Na+、Cl-、SO42- | |
| D. | 由水电离出的c(OH-)=1×10-12mol•L-1的溶液中:NH4+、HCO3-、Na+、Cl- |
| A. | Al2(SO4)3可除去酸性废水中的悬浮颗粒 | |
| B. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性 | |
| C. | 煤通过气化、液化和干馏等可获得清洁能源和重要的化工原料 | |
| D. | 高锰酸钾溶液和双氧水进行环境消毒时原理相同 |
 采用MnO2.其工作原理如图丙所示.电池放电时Na+由a(填写“a”或“b”,下同)极区移向b极区,该电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
采用MnO2.其工作原理如图丙所示.电池放电时Na+由a(填写“a”或“b”,下同)极区移向b极区,该电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.