题目内容
3.下列说法正确的是( )| A. | 硫酸、纯碱、偏铝酸钠和过氧化钠分别属于酸、碱、盐和氧化物 | |
| B. | 乙醇、次氯酸钠和二氧化硫分别属于非电解质、强电解质和弱电解质 | |
| C. | Na、Al、Cu通常分别用电解法、热分解法和置换法冶炼得到 | |
| D. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 |
分析 A.纯碱是碳酸钠,属于盐;
B.电解质是指:在水溶液中或熔融状态下能够导电的化合物,常见的电解质包括:酸、碱、盐、金属氧化物和水;
C.Na、Mg、Al等活泼或较活泼金属:电解法;Fe、Zn、Cu等中等活泼金属:以C、CO或H2做还原剂;Hg、Ag等不活泼金属:热分解法;
D.化石能源:指煤、石油、天燃气等;二次能源:由一次性能源直接或间接转换而来的能源:煤气、氢能、电能、汽油、沼气;可再生能源:不随其本身的转化或被人类利用而减少的能源:太阳能、生物能、水能.
解答 解:A.纯碱是碳酸钠,属于盐,不是碱,故A错误;
B.乙醇、次氯酸钠和二氧化硫分别属于非电解质、强电解质和非电解质,故B错误;
C.Na、Al、Cu可以分别用电解法、电解法和置换法冶炼得到,故C错误;
D.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源,故D正确;
故选:D.
点评 本题为综合题,考查了物质的分类、电解质判断、金属的冶炼,题目难度不大.

练习册系列答案
相关题目
14.已知阴离子R2-的原子核内有n个中子,R原子的质量数为m,则w gR2-所含有电子的物质的量是( )
| A. | $\frac{m-n-2}{w•m}$ mol | B. | $\frac{w?m-n?}{n}$mol | C. | $\frac{w}{m}$(m-n-2)mol | D. | $\frac{w}{m}$(m-n+2)mol |
11.CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:
CO2 (g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分体积分数如下表:
①此温度下该反应的平衡常数K=64
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g) 的△H=+247.3 kJ•mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①在不同温度下催化剂的催化效率与乙酸的生成速率如图1所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低
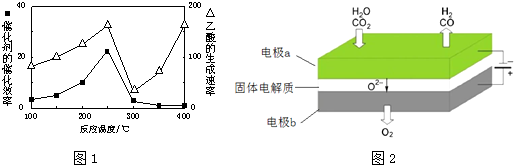
②为了提高该反应中CH4的转化率,可以采取的措施是增大体积减小压强或增大CO2的浓度
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O
(3)Li2O、Na2O、MgO均能吸收CO2.①如果寻找吸收CO2的其他物质,下列建议合理的是ab
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品.
反应A:CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO+H2+O2高温电解技术能高效实现反应A,工作原理示意图2如下:CO2在电极a放电的反应式是CO2+2e-═CO+O2-.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:
CO2 (g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g) 的△H=+247.3 kJ•mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①在不同温度下催化剂的催化效率与乙酸的生成速率如图1所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低

②为了提高该反应中CH4的转化率,可以采取的措施是增大体积减小压强或增大CO2的浓度
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O
(3)Li2O、Na2O、MgO均能吸收CO2.①如果寻找吸收CO2的其他物质,下列建议合理的是ab
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品.
反应A:CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO+H2+O2高温电解技术能高效实现反应A,工作原理示意图2如下:CO2在电极a放电的反应式是CO2+2e-═CO+O2-.
12.氯水既可以用来杀菌消毒,又可作漂白剂,其中起作用的物质是( )
| A. | Cl2 | B. | HCl | C. | HClO | D. | H2O |
13.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0mol•L-1NaClO溶液中:Fe2+、K+、I-、Cl- | |
| B. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| C. | 0.1 mol•L-1NaAlO2 溶液:H+、Na+、Cl-、SO42- | |
| D. | 由水电离出的c(OH-)=1×10-12mol•L-1的溶液中:NH4+、HCO3-、Na+、Cl- |
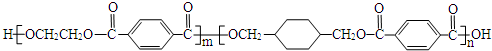

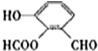
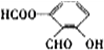 、
、 、
、
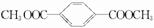 .
.
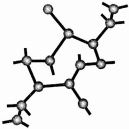 氮化硅是一种新型无机非金属材料,主要有α-氮化硅和β-氮化硅两种晶型,它们都是由[SiN4]正四面体共用顶角原子构成的三维空间网络结构,β-氮化硅的结构如图所示:
氮化硅是一种新型无机非金属材料,主要有α-氮化硅和β-氮化硅两种晶型,它们都是由[SiN4]正四面体共用顶角原子构成的三维空间网络结构,β-氮化硅的结构如图所示: ,若去掉氢原子后的剩余部分即Si44-(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体彼此用3个角氧相连后,形成离子的化学式为Si3O96-.n个硅氧四面体彼此用4个角氧连接后形成的物质的化学式是SiO2.
,若去掉氢原子后的剩余部分即Si44-(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体彼此用3个角氧相连后,形成离子的化学式为Si3O96-.n个硅氧四面体彼此用4个角氧连接后形成的物质的化学式是SiO2.