题目内容
11.NA表示阿伏加德罗常数.下列说法正确的是( )| A. | 5.6g铁粉在0.1 mol氯气中充分燃烧,失去的电子数为0.3NA | |
| B. | 标准状况下,2.24 L CHCl3的分子数为0.1NA | |
| C. | 1L0.1mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA | |
| D. | 9.2gNO2和N2O4的混合气体中含有的氮原子数为0.2NA |
分析 A.铁和氯气反应生成氯化铁,依据全部反应的物质计算电子转移;
B.标况下CHCl3是液态;
C.铝离子为弱碱阳离子,水溶液中部分发生水解;
D.NO2和N2O4的最简式均为NO2.
解答 解:A.5.6g铁粉物质的量为0.1mol,在0.1mol氯气中充分燃烧,氯气全部反应转移电子数为0.2NA,故A错误;
B.标况下CHCl3是液态,不能使用气体摩尔体积,故B错误;
C.铝离子为弱碱阳离子,水溶液中部分发生水解,1L0.1mol/L Al2(SO4)3溶液中,Al3+的数小于0.2NA,故C错误;
D.NO2和N2O4的最简式均为NO2,9.2g NO2和N2O4混合气体中含有NO2的物质的量n=$\frac{9.2g}{46g.mol}$=0.2mol,故含有0.2molN原子,即0.2NA个,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用对象和使用条件,题目难度不大.

练习册系列答案
相关题目
19.下列各组物质中,既不是同系物,又不是同分异构体的是( )
| A. | CH4和C4H10 | B. | 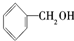 和 和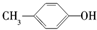 | C. | 乙酸和甲酸甲酯 | D. | 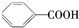 和 和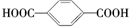 |
6.标准状况下VL HCl气体溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,溶
质的质量分数为ω,物质的量浓度为c mol/L,溶质的质量为mg,则下列关系中不正确的是( )
质的质量分数为ω,物质的量浓度为c mol/L,溶质的质量为mg,则下列关系中不正确的是( )
| A. | m=$\frac{36.5V}{22.4}$ | B. | ω=$\frac{36.5c}{1000ρ}$ | ||
| C. | c=$\frac{1000ρV}{36.5V+22400}$ | D. | c=$\frac{V}{22.4+22.4V}$ |
16.下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
20.若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 20g重水(2H2O)含有10NA个电子 | |
| B. | 常温常压下,1摩氦气含有2NA个原子 | |
| C. | 100mL 1mol/L NaHCO3 溶液含有0.1NA个HCO3- | |
| D. | 5.6g金属铁与足量稀盐酸反应完全反应时,失去 0.3NA个电子 |
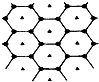 碳的一种单质石墨呈层状结构,有一碳镁新型材料就是在石墨碳原子层间加入镁原子层,两层俯视图:该材料的化学式为MgC2.
碳的一种单质石墨呈层状结构,有一碳镁新型材料就是在石墨碳原子层间加入镁原子层,两层俯视图:该材料的化学式为MgC2.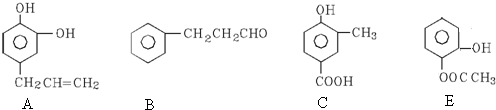
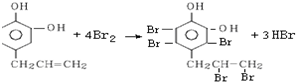 .
.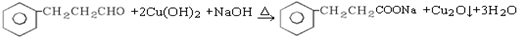 .
.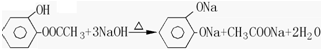 .
.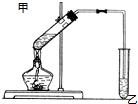 如图在试管甲中先加入2mL 95%的乙醇,再加入2克无水乙酸,充分摇匀,并在摇动下缓缓加入2mL浓硫酸,冷却后,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,再加入2克无水乙酸,充分摇匀,并在摇动下缓缓加入2mL浓硫酸,冷却后,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答: CH3COOC2H5+H2O
CH3COOC2H5+H2O