��Ŀ����
����Ŀ����������ͭ�Ƚ������仯�������ճ�������Ӧ�ù㷺����ش��������⣺
��1���������������壮������FeS2�������������ұ����������Ҫԭ�ϣ�����һ����ӦΪ3FeS2+8O2 ![]() 6SO2+Fe3O4 �� ��������Ϊ �� ����3molFeS2�μӷ�Ӧ��ת��mol���ӣ�
6SO2+Fe3O4 �� ��������Ϊ �� ����3molFeS2�μӷ�Ӧ��ת��mol���ӣ�
��2�����ļ۵����Ų�ʽΪ �� ����������ˮ������ԭ��Ϊ�������ӷ���ʽ��ʾ����
��3������Cu�����백ˮ����˫��ˮ������Ӧ����������ߵĻ����Һ��Ӧ��������ɫ��Һ��Cu�백ˮ��˫��ˮ��Ӧ�����ӷ���ʽ��
��4��������һ�ֺ�ɫ���ϣ���ɷ���Fe2O3 �� ��һ��������������160mL5molL��1�����У��ټ���һ��������ǡ���ܽ⣬�ռ���2.24L��������״�������������Һ����Fe3+ �� �μӷ�Ӧ�����۵�����Ϊ ��
���𰸡�
��1��������SO2��Fe3O4��32
��2��3s23p1��Al3++3H2O=Al��OH��3�����壩+3H+
��3��Cu+4NH3?H2O+H2O2=[Cu��NH3��4]2++4H2O+2OH��
��4��11.2g
�������� �⣺��1�����������ڽ������ʣ�Ϊ�������壬��Ӧ3FeS2+8O2=Fe3O4+6SO2 �� ǰ���Ԫ�ػ��ϼ۵ı仯������£�Fe��+2��+3�����ϼ����ߣ�S����1��+4�����ϼ����ߣ�O��0����2�����ϼ۽��ͣ���ˣ��ڷ�Ӧ��FeS2��ԭ����O2����������Fe3O4������������Ҳ�ǻ�ԭ���SO2������������Ҳ�ǻ�ԭ�����������Ӧ�й�ת��32�����ӣ���3molFeS2�μӷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ32mol�����Դ��ǣ�������SO2��Fe3O4�� 32����2��Al��13��Ԫ�أ����ݹ���ԭ��֪���̬ԭ�ӵ����Ų�ʽΪ1s22s22p63s23p1 �� ��۵������������ӣ����Լ۵����Ų�ʽΪ3s23p1 �� ��������Һ����ȫ����������ӡ������Ӻ���������ӣ����뷽��ʽΪ��KAl��SO4��2=K++Al3++2SO42�� �� ������ˮԭ��������������Һ�к��������ӣ�������ˮ��Al3++3H2O=Al��OH��3�����壩+3H+ �� ���Դ��ǣ�3s23p1��Al3++3H2O=Al��OH��3�����壩+3H+����3������Cu�����백ˮ����˫��ˮ������Ӧ����������ߵĻ����Һ��Ӧ��������ɫ��Һ��˵����Ӧ����[Cu��NH3��4]2+ �� ��Ӧ���ӷ���ʽΪ��Cu+4NH3H2O+H2O2=[Cu��NH3��4]2++4H2O+2OH�� �� ���Դ��ǣ�Cu+4NH3H2O+H2O2=[Cu��NH3��4]2++4H2O+2OH������4�����������ʵ���Ϊ 0.1mol��
�ɹ�ϵʽ
Fe�������� | 2HCl������ | H2 |
0.1mol | 0.2mol | 0.1mol |
�� �õ�
������ԭ���غ㣬�����Ȼ��������ʵ���Ϊ ![]() ����0.16L��5mol/L��0.2mol��=0.2mol��
����0.16L��5mol/L��0.2mol��=0.2mol��
Fe������ | 2FeCl3 |
0.1mol | 0.2mol |
���Բμӷ�Ӧ�����۵�����Ϊ��0.1mol+0.1mol����56g/mol=11.2g�����Դ��ǣ�11.2g��

 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�����Ŀ���о���ѧϰС�����������й�װ�ý���̽��ʵ�飬�ش�������⡣
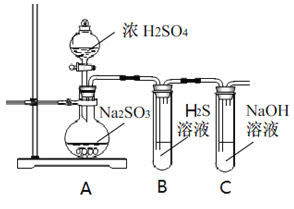

��1��д��A�еķ�Ӧ��ѧ����ʽ_______________________________________________________
��2��ʵ��ʱ������װ��A�з�Һ©��������������Һ����������������ֹͣ������ܵ�ԭ����_________________________________��
��3��װ��B�е���Һ���ֻ��ǣ���ʵ��֤��SO2����___�� ��
��4��ʵ��ⶨװ��C����Һ�ʼ��ԡ���ҺΪʲô�ʼ����أ�����в�ͬ������������ɵ�Na2SO3ˮ�⣻������������ʣ�ࡣ�����ʵ�鷽��֤���������������ѡ�������Լ�����ʵ�飺Na2SO3��Һ����̪��Һ����ˮ��BaCl2��Һ��ϡ����
ʵ�鲽�� | ʵ����� | Ԥ����������� |
_____ | _______________ | _______________ |
��5����һС������װ��D����ʵ�飺��ע������װ��D��ע��v mLʵ�����Ʊ�SO2�Ŀ���������Һ�պ���ɫ��ֹͣʵ�顣��С���ʵ��Ŀ����_________________________________��


