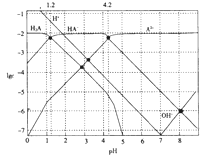
题目内容
【题目】实验室制备下列物质时,不用加入浓H2SO4的是( )
A.由苯制取硝基苯
B.用乙酸和乙醇制备乙酸乙酯
C.由溴乙烷制乙烯
D.由乙醇制乙烯
【答案】C
【解析】解:A.由苯制取硝基苯,加入浓硫酸,浓硫酸作催化剂、吸水剂,故A不符合题意;
B.用乙酸和乙醇制备乙酸乙酯,加入浓硫酸,浓硫酸作催化剂、吸水剂,故B不符合题意;
C.溴乙烷在氢氧化钠水溶液的条件下发生反应得到乙烯,没有加入浓硫酸,故C符合题意;
D.由乙醇制乙烯,加入浓硫酸,浓硫酸作催化剂、脱水剂,故D不符合题意;
故答案为:C.
本题考察的内容是常见有机物的制备实验,着眼点是硫酸的作用(催化剂、吸水剂、脱水剂),需要学生掌握浓硫酸的特性极其用途。

【题目】研究性学习小组利用下列有关装置进行探究实验,回答相关问题。
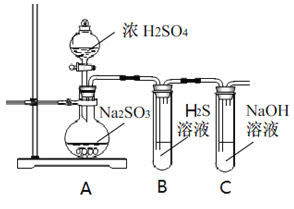

(1)写出A中的反应化学方程式_______________________________________________________
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是_________________________________。
(3)装置B中的溶液出现浑浊,该实验证明SO2具有___性 。
(4)实验后,测定装置C中溶液呈碱性。溶液为什么呈碱性呢?大家有不同意见:①是生成的Na2SO3水解;②是氢氧化钠剩余。请设计实验方案证明哪种意见成立。选用下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
实验步骤 | 实验操作 | 预期现象与结论 |
_____ | _______________ | _______________ |
(5)另一小组利用装置D进行实验:用注射器向装置D共注入v mL实验室制备SO2的空气,当溶液刚好褪色,停止实验。该小组的实验目的是_________________________________。
【题目】利用废碱渣(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,可制得无水Na2SO3(成品),其流程如图所示。
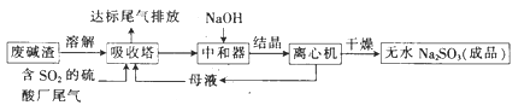
(1)某硫酸厂排放出的尾气中SO2的含量特别髙,而废碱渣的量不足,此时“吸收塔”内发生反应的离子方程式为_______________(不考虑H2O与SO2反应)。
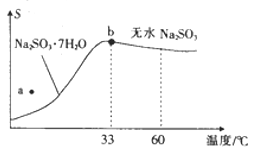
(2)亚硫酸钠的溶解度曲线如图所示,则上述流程中“结晶”的方法是___________(填“蒸发结晶”或“降温结晶”),图中a点所示分散系类别为____________(填“浊液”“胶体”或“溶液”)。
(3)仅用BaCl2、H2O2和过量稀盐酸的混合溶液难以检出“成品”中的SO32-,原因是“成品”中含有某种杂质阴离子。
①该杂质阴离子为________________(填离子符号)。
②25℃时,部分钡盐的Ksp如下表所示。
化学式 | BaSO4 | BaSO3 |
Ksp | 1.1×10-10 | 5.5×10-7 |
将得到的“成品”溶于水,测得溶液中SO32-的浓度为0.5mol L-1,为杂质阴离子浓度的10倍,向该溶液中加入等体积、0.5mol·L-1的BaCl2溶液,充分反应后c(Ba2+)=_______mol L-1。(混合时溶液体积的变化忽略不计)
(4)某同学采用如下方法检验SO32-:
![]()
①洗涤时使用的试剂最好为____________(填字母)。
a.稀HNO3 b.蒸馏水 c.稀H2SO4
②根据上述流程中的数据(w、x、y)_____________ (填“能”或“不能”)计算出成品试样中SO32-的百分含量,若能,则SO32-的百分含量为 (若不能,则此空不填);若不能,则理由是_____________(若能,则此空不填)。