题目内容
【题目】下列离子方程式正确的是( )
A. 碳酸氢钠溶液与少量澄清石灰水反应:HC![]() +Ca2++OH-CaCO3↓+H2O
+Ca2++OH-CaCO3↓+H2O
B. 氯化铵与氢氧化钠两种溶液混合加热:N![]() +OH-
+OH-![]() H2O+NH3↑
H2O+NH3↑
C. 钠和冷水反应:Na+2H2ONa++2OH-+H2↑
D. 向氯化铝溶液中滴加过量氨水:Al3++3OH-Al(OH)3↓
【答案】B
【解析】A. 碳酸氢钠溶液与少量澄清石灰水反应生成碳酸钙、碳酸钠和水,A错误;B. 氯化铵与氢氧化钠两种溶液混合加热放出氨气:NH4++OH-![]() H2O+NH3↑,B正确;C. 钠和冷水反应生成氢氧化钠和氢气:2Na+2H2O=2Na++2OH-+H2↑,C错误;D. 向氯化铝溶液中滴加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+,D错误,答案选B。
H2O+NH3↑,B正确;C. 钠和冷水反应生成氢氧化钠和氢气:2Na+2H2O=2Na++2OH-+H2↑,C错误;D. 向氯化铝溶液中滴加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+,D错误,答案选B。

【题目】研究性学习小组利用下列有关装置进行探究实验,回答相关问题。
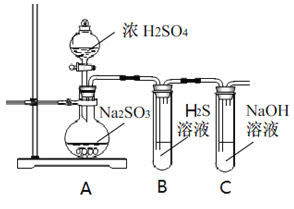

(1)写出A中的反应化学方程式_______________________________________________________
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是_________________________________。
(3)装置B中的溶液出现浑浊,该实验证明SO2具有___性 。
(4)实验后,测定装置C中溶液呈碱性。溶液为什么呈碱性呢?大家有不同意见:①是生成的Na2SO3水解;②是氢氧化钠剩余。请设计实验方案证明哪种意见成立。选用下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
实验步骤 | 实验操作 | 预期现象与结论 |
_____ | _______________ | _______________ |
(5)另一小组利用装置D进行实验:用注射器向装置D共注入v mL实验室制备SO2的空气,当溶液刚好褪色,停止实验。该小组的实验目的是_________________________________。
【题目】利用废碱渣(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,可制得无水Na2SO3(成品),其流程如图所示。
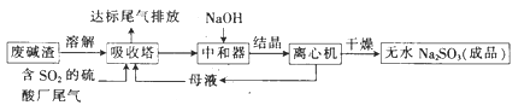
(1)某硫酸厂排放出的尾气中SO2的含量特别髙,而废碱渣的量不足,此时“吸收塔”内发生反应的离子方程式为_______________(不考虑H2O与SO2反应)。
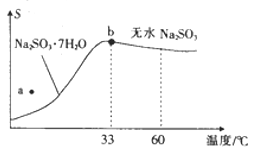
(2)亚硫酸钠的溶解度曲线如图所示,则上述流程中“结晶”的方法是___________(填“蒸发结晶”或“降温结晶”),图中a点所示分散系类别为____________(填“浊液”“胶体”或“溶液”)。
(3)仅用BaCl2、H2O2和过量稀盐酸的混合溶液难以检出“成品”中的SO32-,原因是“成品”中含有某种杂质阴离子。
①该杂质阴离子为________________(填离子符号)。
②25℃时,部分钡盐的Ksp如下表所示。
化学式 | BaSO4 | BaSO3 |
Ksp | 1.1×10-10 | 5.5×10-7 |
将得到的“成品”溶于水,测得溶液中SO32-的浓度为0.5mol L-1,为杂质阴离子浓度的10倍,向该溶液中加入等体积、0.5mol·L-1的BaCl2溶液,充分反应后c(Ba2+)=_______mol L-1。(混合时溶液体积的变化忽略不计)
(4)某同学采用如下方法检验SO32-:
![]()
①洗涤时使用的试剂最好为____________(填字母)。
a.稀HNO3 b.蒸馏水 c.稀H2SO4
②根据上述流程中的数据(w、x、y)_____________ (填“能”或“不能”)计算出成品试样中SO32-的百分含量,若能,则SO32-的百分含量为 (若不能,则此空不填);若不能,则理由是_____________(若能,则此空不填)。
【题目】化学反应原理在化工生产和实验中有着广泛而重要的应用。
Ⅰ.利用含锰废水(主要含Mn2+、SO![]() 、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工艺流程如下:
、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工艺流程如下:

已知某些物质完全沉淀的pH如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
沉淀完全时的pH | 3.2 | 5.4 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
回答下列问题:
(1)过程②中,所得滤渣W的主要成分是______________________。
(2)过程③中,发生反应的离子方程式是______________________。
(3)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3的反应的离子方程式是_______________________。
(4)由MnCO3可制得重要的催化剂MnO2:2MnCO3+O2===2MnO2+2CO2。现在空气中加热460.0 g MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是________(用百分数表示,小数点后保留1位小数)。
Ⅱ.常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN/span> | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)上述盐溶液中的阴离子,结合H+能力最强的是_______________________。
(2)根据表中数据判断,浓度均为0.01 mol·L-1的下列物质的溶液中,酸性最强的是________(填序号)。
A. HCN B. HClO C. C6H5OH D. CH3COOH E. H2CO3
Ⅲ.已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH = Q kJ·mol-1其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH = Q kJ·mol-1其平衡常数随温度变化如下表所示:
温度/℃ | 400 | 500 | 850 |
平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___,该反应的Q____(填“>”或“<”)0。
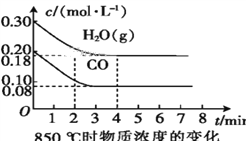
(2)850 ℃时,向体积为10 L的反应器中通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)的浓度变化如图所示,则0~4 min时平均反应速率v(CO)=____。
(3)若在500 ℃时进行上述反应,且CO、H2O(g)的起始浓度均为0.020 mol·L-1,该条件下,CO的最大转化率为____。
(4)若在850 ℃时进行上述反应,设起始时CO和H2O(g)共为1 mol,其中水蒸气的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的关系式:____。