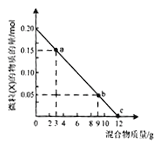
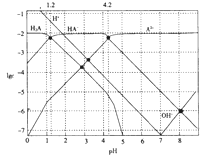
题目内容
【题目】下列反应不属于氧化还原反应的是
A. Fe+CuSO4===FeSO4+Cu B. NH4HCO3![]() NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
C. Cl2+H2O![]() HCl+HClO D. Fe2O3+3CO
HCl+HClO D. Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
【答案】B
【解析】A. Fe+CuSO4=FeSO4+Cu是置换反应,Fe元素和Cu元素的化合价发生变化,属于氧化还原反应,故A不选;B. 在NH4HCO3![]() NH3↑+H2O+CO2↑反应中,没有元素化合价发生变化,不属于氧化还原反应,故B选;C. 在Cl2+H2O
NH3↑+H2O+CO2↑反应中,没有元素化合价发生变化,不属于氧化还原反应,故B选;C. 在Cl2+H2O![]() HCl+HClO反应中,氯元素的化合价发生变化,属于氧化还原反应,故C不选;D. 在Fe2O3+3CO
HCl+HClO反应中,氯元素的化合价发生变化,属于氧化还原反应,故C不选;D. 在Fe2O3+3CO![]() 2Fe+3CO2反应中,Fe元素和C元素的化合价发生变化,属于氧化还原反应,故D不选;答案选B。
2Fe+3CO2反应中,Fe元素和C元素的化合价发生变化,属于氧化还原反应,故D不选;答案选B。

【题目】
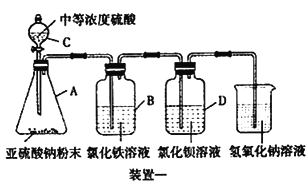
工业上常利用含硫废水生产Na2S2O3 ·5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程。实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品。
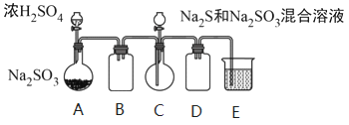
已知:i.烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (a)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l)(b)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq) (c)
Na2S2O3(aq) (c)
ii.BaS2O3易溶于水。
(1)E中的试剂是__________。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为__________。
(3)已知反应(c)相对较慢,则烧瓶C中反应达到终点的现象是__________。
(4)产品中常含有Na2SO3和Na2SO4。该小组设计了以下实验方案进行检验。
步骤 | 实验操作 | 实验现象 |
Ⅰ | 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 |
Ⅱ | 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量__________ | 沉淀未完全溶解,并有刺激性气味的气体产生 |
①步骤Ⅱ中加入的试剂可以是__________(填序号)。
A.稀硫酸 B.稀盐酸 C.稀硝酸 D.氢氧化钠溶液
②步骤Ⅱ设计过滤操作的目的是(用化学方程式简要文字表述)__________。
(5)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原实验步骤进行了改进,改进后的操作是__________。
(6)Na2S2O3常用作脱氯剂。Na2S2O3溶液与Cl2反应的离子方程式为__________。
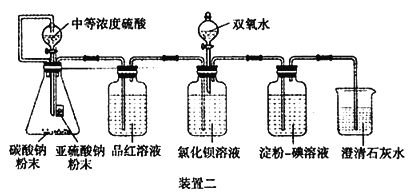
【题目】研究性学习小组利用下列有关装置进行探究实验,回答相关问题。
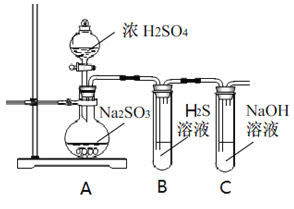

(1)写出A中的反应化学方程式_______________________________________________________
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是_________________________________。
(3)装置B中的溶液出现浑浊,该实验证明SO2具有___性 。
(4)实验后,测定装置C中溶液呈碱性。溶液为什么呈碱性呢?大家有不同意见:①是生成的Na2SO3水解;②是氢氧化钠剩余。请设计实验方案证明哪种意见成立。选用下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
实验步骤 | 实验操作 | 预期现象与结论 |
_____ | _______________ | _______________ |
(5)另一小组利用装置D进行实验:用注射器向装置D共注入v mL实验室制备SO2的空气,当溶液刚好褪色,停止实验。该小组的实验目的是_________________________________。