题目内容
【题目】按要求回答下列问题:
(1)新制氯水在阳光照射下缓慢产生的无色气体为_______(填化学式)。
(2)氢氟酸若用玻璃试剂瓶盛装,发生的主要反应的化学方程式为_______。
(3)实验室常用Al2(SO4)3和NH3·H2O制备Al(OH)3其反应的离子方程式为_______。
(4)用玻璃棒蘸浓硫酸滴在火柴梗上,火柴梗变黑,浓硫酸表现出来的性质为_______。
(5)维生素C能将人体摄取的Fe3+转变为Fe2+,说明维生素C具有_______(选填“氧化性”或“还原性”)。
【答案】 O2 SiO2+4HF=SiF4↑+2H2O Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 脱水性 还原性
【解析】(1)新制的氯水中发生如下反应:Cl2+H2O![]() HCl+HClO,由于次氯酸不稳定,见光分解2HClO
HCl+HClO,由于次氯酸不稳定,见光分解2HClO![]() 2HCl+O2↑,所以产生的无色气体为O2;
2HCl+O2↑,所以产生的无色气体为O2;
(2)氢氟酸能够与玻璃的成分SiO2反应,反应的化学方程式为SiO2+4HF=SiF4↑+2H2O;
(3)由于NH3·H2O属于弱碱,不能溶解Al(OH)3,从而能提高产物的产量,所以实验室常用Al2(SO4)3和NH3·H2O反应制备Al(OH)3,其反应的离子方程式为Al3++3NH3·H2O= Al(OH)3↓+ 3NH4+;
(4)浓硫酸具有脱水性,能够把有机物中的H和O按2:1的原子个数比夺出来形成水,火柴梗为有机物纤维素,被浓硫酸脱水后生成黑色的碳,表现了浓硫酸的脱水性;
(5)Fe3+转变为Fe2+,化合价降低,表现出氧化性,所以维生素C在此过程中表现出还原性。

【题目】用下图所示装置进行下列实验,实验结果与预测的现象不一致的是
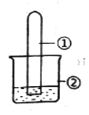
选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
A | NO2 | 蒸馏水 | 试管充满无色溶液 |
B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
C | NH3 | AlCl3溶液 | 产生白色沉淀 |
D | Cl2 | AgNO3溶液 | 产生白色沉淀 |
A. A B. B C. C D. D
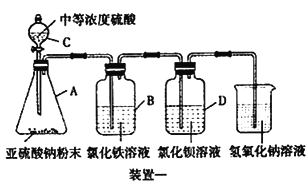
【题目】研究性学习小组利用下列有关装置进行探究实验,回答相关问题。
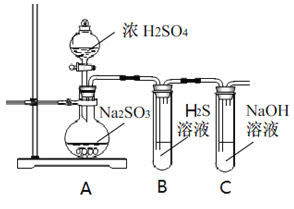

(1)写出A中的反应化学方程式_______________________________________________________
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是_________________________________。
(3)装置B中的溶液出现浑浊,该实验证明SO2具有___性 。
(4)实验后,测定装置C中溶液呈碱性。溶液为什么呈碱性呢?大家有不同意见:①是生成的Na2SO3水解;②是氢氧化钠剩余。请设计实验方案证明哪种意见成立。选用下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
实验步骤 | 实验操作 | 预期现象与结论 |
_____ | _______________ | _______________ |
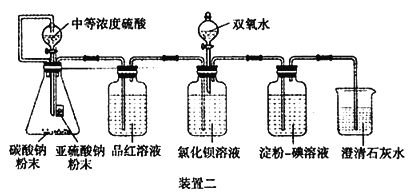
(5)另一小组利用装置D进行实验:用注射器向装置D共注入v mL实验室制备SO2的空气,当溶液刚好褪色,停止实验。该小组的实验目的是_________________________________。
【题目】利用废碱渣(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,可制得无水Na2SO3(成品),其流程如图所示。
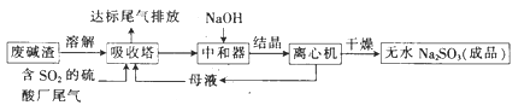
(1)某硫酸厂排放出的尾气中SO2的含量特别髙,而废碱渣的量不足,此时“吸收塔”内发生反应的离子方程式为_______________(不考虑H2O与SO2反应)。
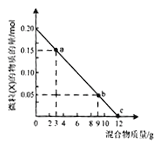
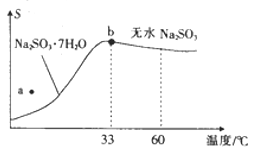
(2)亚硫酸钠的溶解度曲线如图所示,则上述流程中“结晶”的方法是___________(填“蒸发结晶”或“降温结晶”),图中a点所示分散系类别为____________(填“浊液”“胶体”或“溶液”)。
(3)仅用BaCl2、H2O2和过量稀盐酸的混合溶液难以检出“成品”中的SO32-,原因是“成品”中含有某种杂质阴离子。
①该杂质阴离子为________________(填离子符号)。
②25℃时,部分钡盐的Ksp如下表所示。
化学式 | BaSO4 | BaSO3 |
Ksp | 1.1×10-10 | 5.5×10-7 |
将得到的“成品”溶于水,测得溶液中SO32-的浓度为0.5mol L-1,为杂质阴离子浓度的10倍,向该溶液中加入等体积、0.5mol·L-1的BaCl2溶液,充分反应后c(Ba2+)=_______mol L-1。(混合时溶液体积的变化忽略不计)
(4)某同学采用如下方法检验SO32-:
![]()
①洗涤时使用的试剂最好为____________(填字母)。
a.稀HNO3 b.蒸馏水 c.稀H2SO4
②根据上述流程中的数据(w、x、y)_____________ (填“能”或“不能”)计算出成品试样中SO32-的百分含量,若能,则SO32-的百分含量为 (若不能,则此空不填);若不能,则理由是_____________(若能,则此空不填)。