题目内容
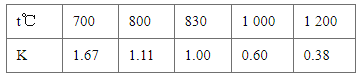
【题目】25℃时在10mL0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是( )
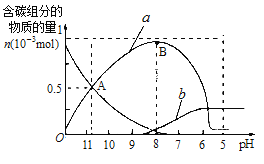
A.A点时:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
B.当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1moL·L-1
C.a、b曲线分别代表的是HCO3-、H2CO3量的变化情况
D.Na2CO3溶液中c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
【答案】B
【解析】
A、A点时CO32-和HCO3-物质的量相同,溶液显碱性,且c(Na+)最大,故c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+),选项A正确;
B、n(HCO3-)=0.0001mol时,溶液的pH=8,所以加入0.1mol/LHCl溶液10mL,恰好与盐酸完全反应生成碳酸氢钠和氯化钠,所以溶液中NaHCO3的物质的量浓度为0.05mol/L,选项B不正确;
C、碳酸钠和盐酸反应的过程:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,根据变化曲线,推出a曲线是HCO3-,b曲线是H2CO3,选项C正确;
D、根据物料守恒:碳酸钠溶液中c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),选项D正确;
答案选B。

【题目】中学化学中很多“规律”都有适用范围,下列根据有关“规律”推出的结论错误的有( )
序号 | 规律 | 结论 |
① | 活泼金属的氧化物为碱性氧化物 |
|
② | 酸与酸性氧化物不能发生反应 | 氢氟酸可以储存在玻璃试剂瓶中 |
③ | 较弱酸不能制取较强酸 | 氢硫酸不能制取硫酸 |
④ | 复分解反应均不是氧化还原反应 | 酸碱中和反应中没有电子的转移 |
A.①②③B.②③④C.①③④D.①②④