题目内容
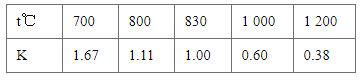
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如下表,下列有关叙述不正确的是
,在不同的温度下该反应的平衡常数如下表,下列有关叙述不正确的是
A.该反应的化学方程式是CO(g)+H2O(g)CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol,该反应达到平衡状态
D.若平衡浓度符合关系式![]() =
=![]() ,则此时的温度为1000 ℃
,则此时的温度为1000 ℃
【答案】C
【解析】
A. 依据平衡常数表达式是生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到化学方程式式为K=![]() ,化学方程式为:CO(g)+H2O(g) CO2(g)+H2(g),故A正确;
,化学方程式为:CO(g)+H2O(g) CO2(g)+H2(g),故A正确;
B. 分析图表数据,平衡常数随温度升高减小,说明升温平衡逆向进行逆向是吸热反应,正反应是放热反应,故B正确;
C. 依据化学平衡三段式列式计算浓度商和平衡常数比较分析,若在一定体积的密闭容器中通入CO2和H2各1mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol时,
CO(g)+H2O(g)═CO2(g)+H2(g)
起始量(mol) 0 0 1 1
变化量(mol) 0.4 0.4 0.4 0.4
平衡量(mol) 0.4 0.4 0.6 0.6
反应前后气体物质的量不变,可以用其物质的量代替平衡浓度计算,Q=![]() =2.25≠1,此时反应没有达到平衡状态,故C错误;
=2.25≠1,此时反应没有达到平衡状态,故C错误;
D. 依据平衡常数表达式和平衡常数数值计算分析,温度为1000℃平衡常数K=![]() =0.6=
=0.6=![]() ,若平衡浓度符合下列关系:
,若平衡浓度符合下列关系:![]() =
=![]() ,说明反应达到平衡状态,故D正确;
,说明反应达到平衡状态,故D正确;
答案选C。

练习册系列答案
相关题目