题目内容
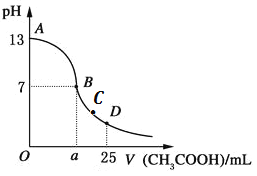
【题目】根据如图所示示意图,下列说法不正确的是

A. 反应的热化学方程式可表示为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B. 该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C. a mol C和a mol H2O反应生成a mol CO和a mol H2吸收的热量一定为131.3a kJ
D. 1 mol C(g)、2 mol H、1 mol O转变成1 mol CO(g)和1 mol H2(g)放出的热量为a kJ
【答案】C
【解析】A. 由图可知,该反应为吸热反应,反应的热化学方程式可表示为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=(b-a) kJ·mol-1,A正确;B. 该反应过程反应物断键吸收的能量大于生成物成键放出的能量,B正确;C. a mol C和a mol H2O(气态)反应生成a mol CO和a mol H2吸收的热量一定为131.3a kJ,C不正确,没有指明水水的状态;D.由图可知, 1 mol C(g)、2 mol H、1 mol O转变成1 mol CO(g)和1 mol H2(g)放出的热量为a kJ,D正确。本题选C。
CO(g)+H2(g) ΔH=(b-a) kJ·mol-1,A正确;B. 该反应过程反应物断键吸收的能量大于生成物成键放出的能量,B正确;C. a mol C和a mol H2O(气态)反应生成a mol CO和a mol H2吸收的热量一定为131.3a kJ,C不正确,没有指明水水的状态;D.由图可知, 1 mol C(g)、2 mol H、1 mol O转变成1 mol CO(g)和1 mol H2(g)放出的热量为a kJ,D正确。本题选C。

【题目】TiC14是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去):
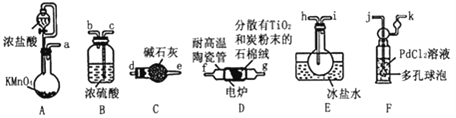
已知:
①PdC12溶液捕获CO时,生成金属单质和两种酸性气体化合物。
②TiC14的制备需无水无氧且加热。
③
化合物 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 水溶性 |
TiCl4 | -25 | 136.4 | 1.5 | 易水解生成难溶于水的物质,能溶于有机溶剂 |
CCl4 | -23 | 76.8 | 1.6 | 难溶于水,与TiCl4互溶 |
请回答下列问题:
(1)装置D中除生成TiCl4外,同时生成一种气态不成盐氧化物,该反应的化学方程式为__________________。
(2)按照气流由左到右的方向,上述装置合理的连接顺序为a→____→____→f→g→___→____→_____→_____→_____(填仪器接口字母)。
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;_____________(按正确的顺序填入下列操作的序号)。
①加热装置D中陶瓷管 ②打开分液漏斗活塞
③停止加热,充分冷却 ④关闭分液漏斗活塞
实验时,当观察到____________________________时,开始进行步骤①。
(4)设计实验证明装置E中收集到的液体中含有TiCl4:___________。
(5)装置F中发生反应的化学方程式为____________________。
(6)制得的TiC14产品中常含有少量CC14,从产品中分离出TiC14的操作名称为_____________________________。
【题目】工业上用苯和1,2—二氯乙烷制联苄的反应原理如下
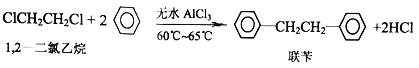
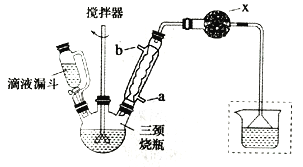
实验室制取联苄的装置如图所示(加热和夹持仪器略去)
实验步骤:
①在三颈烧瓶中加入120.0mL苯和适量无水AlCl3,由滴液漏斗滴加10.0mL 1,2-二氯乙烷,控制反应温度在60~65℃,反应约60min。
②将反应后的混合物依次用2%Na2CO3溶液和水洗涤,在所得产物中加入少量无水MgSO4固体,静置、过滤,蒸馏收集一定温度下的馏分,得联苄18.2g。
相关物理常数和物理性质如下表:
名称 | 相对分子质量 | 密度/g·cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶于水,易溶于乙醇 |
1,2-二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶于水,可溶于苯 |
联苄 | 182 | 0.98 | 52 | 284 | 难溶于水,易溶于苯 |
(1)和普通分液漏斗相比,使用滴液漏斗的优点是_______________________;球形冷凝管进水口是____________(选填“a”或“b”)
(2)仪器X的名称是________________;装置中虚线部分的作用是____________。
(3)洗涤操作中,用2%Na2CO3溶液洗涤的目的是___________;水洗的目的是____________。
(4)在进行蒸馏操作时,应收集____________℃的馏分。
(5)该实验中,联苄的产率约为____________%(小数点后保留两位)。