��Ŀ����
����Ŀ��![]() ʱ��
ʱ��![]()
![]() ��ˮ�����Ļ�������������
��ˮ�����Ļ�������������![]() ��ַ�Ӧ��������������
��ַ�Ӧ��������������![]() ���ٽ���Ӧ��ʣ�������ȴ����뺬��
���ٽ���Ӧ��ʣ�������ȴ����뺬��![]() ��
��![]() ��
��![]() ��
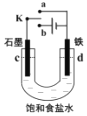
��![]() �����ӵ�ˮ��Һ�У�����Һ������ֲ��䣬������˵������ȷ����( )
�����ӵ�ˮ��Һ�У�����Һ������ֲ��䣬������˵������ȷ����( )
A.ԭ��������ƽ��Ħ������Ϊ![]()
B.���������![]() ��Ӧ�����е���ת�Ƶ����ʵ���Ϊ
��Ӧ�����е���ת�Ƶ����ʵ���Ϊ![]()
C.��Һ��![]() �����ʵ���Ũ�Ȼ������ֲ���
�����ʵ���Ũ�Ȼ������ֲ���
D.��Һ��![]() �����ʵ���Ũ�ȼ�С��
�����ʵ���Ũ�ȼ�С��![]() �����ʵ���Ũ��������
�����ʵ���Ũ��������![]() ��
��![]() �����ʵ���Ũ��֮�ͻ������ֲ���
�����ʵ���Ũ��֮�ͻ������ֲ���
���𰸡�A
��������
�������Ĺ���![]() ��ͨ��
��ͨ��![]() ��
��![]() ������ֻ����
������ֻ����![]() ������Ϊ����
������Ϊ����![]() �����������غ㶨�ɿ�֪
�����������غ㶨�ɿ�֪![]() ������
������![]() ��
��
A.���ݷ���ʽ![]() ��
�� ![]() ��֪��������
��֪��������![]() ����ˮ��������2mol����1molO2��������0.25molO2����
����ˮ��������2mol����1molO2��������0.25molO2����![]() ��ˮ�����������ʵ�����0.5mol������ԭ��������ƽ��Ħ������Ϊ
��ˮ�����������ʵ�����0.5mol������ԭ��������ƽ��Ħ������Ϊ![]() ����A��ȷ��
����A��ȷ��
B.��Ӧ����������Ϊ![]() ����Ԫ����-1��Ϊ0��ת�Ƶ���Ϊ
����Ԫ����-1��Ϊ0��ת�Ƶ���Ϊ![]() ����B����
����B����
C.����������ʣ�࣬��������![]() ����Һ��
����Һ��![]() �����ʵ���Ũ�ȼ�С����C����
�����ʵ���Ũ�ȼ�С����C����
D.���ڷ�Ӧ������к���̼���ƣ���Һ![]() ��
��![]() �����ʵ���Ũ��֮������D����
�����ʵ���Ũ��֮������D����
��ѡA��

����Ŀ������ʵ����������ó��Ľ��۾���ȷ����
ѡ�� | ʵ����� | ���� | ���� |
A | ��ʢ��Ʒ�����ֻ�Թ��зֱ�ͨ��SO2��Cl2 | Ʒ�����ɫ | ����Ư��ԭ����ͬ |
B | �������ͬ��pH��Ϊ3.3��һԪ��HX��HY�зֱ��������п�� | ������H2ǰ�߱Ⱥ��߶� | HX��HY�������� |
C | ��������FeS��CuS�зֱ����0.3mol/L���� | ǰ���ܽ⣬���߲��� | Ksp(FeS)>Ksp(CuS) |
D | ��ʢ����ͬ�����10%H2O2��Һ����ֻ�Թ��зֱ������������KMnO4��Һ��FeCl3��Һ | ǰ�߲���������� | KMnO4�����Ա�FeCl3�� |
A. A B. B C. C D. D
����Ŀ��ij��ȤС��������ͼ��ʾ���װ�ã����ּг�װ��δ����������̽��ʵ�顣
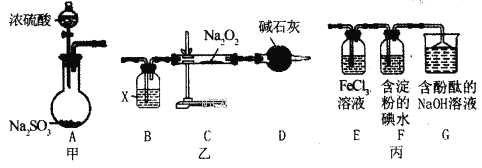
��ش��������⣺
��1��Aͬѧ���ס���װ����Ͻ���ʵ�飬��ʵ��Ŀ����̽��__��Ӧ������������Ӻ�װ�ú�����Ҫ���е�ʵ�����Ϊ___��
��2��Ϊ����Cװ���з�Ӧ�������Ƿ���������װ��B��ʢ�ŵ��Լ�XӦΪ__��װ��D�м�ʯ�ҵ�������__��
��3��Bͬѧ���ס���װ����Ͻ���ʵ�飬��˵��I-�Ļ�ԭ������SO2������Ϊ__��������Ӧ�����ӷ���ʽ��__��
��4��װ��G�е�������__��˵��SO2����__�ԡ�
��5��Ϊ��֤װ��E��SO2��FeCl3������������ԭ��Ӧ��Cͬѧ�����������������±���
ʵ����� | ʵ������ | ʵ����� | |
����1 | ȡ����װ��E�е���Һ���Թ��У������еμ�___��Һ | ������ɫ���� | SO2��FeCl3������������ԭ��Ӧ |
����2 | ȡ����װ��E�е���Һ���Թ��У������еμ�___��Һ | ___ |