题目内容
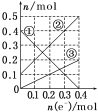
【题目】向某氨水中加入醋酸溶液,反应方程式如下:NH3·H2O+CH3COOH=CH3COONH4+H2O滴加过程,溶液的导电能力(I)与加入醋酸溶液的体积(V)关系正确的是( )
A.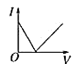 B.
B.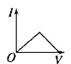 C.
C.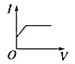 D.
D.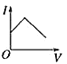
【答案】D
【解析】
电解质溶液导电性强弱与离子浓度有关,离子浓度越大,其导电性越大,据此分析解答。
电解质溶液导电性强弱与离子浓度有关,离子浓度越大,其导电性越大,一水合氨是弱电解质,水溶液中离子浓度较小,反应开始时溶液的导电能力较弱,醋酸是弱电解质,但二者反应生成的醋酸铵是可溶性的强电解质,二者混合后导致溶液中离子浓度增大,溶液导电性增强。当溶液体积无限增大时,相当于稀醋酸溶液,离子浓度几乎不变,则溶液导电性几乎不变,所以图象上随氨水体积的增大,导电性先增大后减小,合理选项是D。

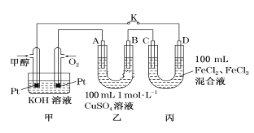
【题目】利用如图装置测定中和热的实验步骤如下:
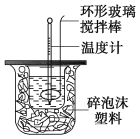
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol): ______。
(2)倒入NaOH溶液的正确操作是________(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________(从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ____________________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②上述实验测量结果得出的中和热的数值与57.3 kJ/mol相比偏小,产生的原因可能是(填字母)_________。
a.实验装置保温、隔热效果差 b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度