题目内容
5.下列关于水的说法正确的是( )| A. | 纯水几乎不导电,因此水是非电解质 | |
| B. | 在任何温度下,纯水的pH均等于7 | |
| C. | 向水中加入钠,溶液中$\frac{{K}_{w}}{c(O{H}^{-})}$减小 | |
| D. | 向水中加入醋酸,c(H+)和水的电离均增大 |
分析 A、水能微弱的电离为氢离子和氢氧根离子;
B、纯水永远显中性;
C、向水中加入钠后,溶液显碱性,溶液中的c(OH-)增大;
D、醋酸对水的电离有抑制作用.
解答 解:A、水能微弱的电离为氢离子和氢氧根离子,故水为弱电解质,故A错误;
B、纯水中c(OH-)=c(H+),即纯水永远显中性,但只有在25℃时,Kw=10-14,才有c(OH-)=c(H+)=10-7mol/L,即中性溶液的pH才为7,故B错误;
C、向水中加入钠后,溶液显碱性,溶液中的c(OH-)增大,而Kw值不变,故$\frac{{K}_{w}}{c(O{H}^{-})}$变小,故C正确;
D、醋酸对水的电离有抑制作用,故向水中加入醋酸后,溶液中氢离子浓度增大,但水的电离程度减小,故D错误.
故选C.
点评 本题考查了水的电离和纯水的酸碱性,难度不大,应注意的是纯水无论在什么温度下均显中性.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
16.有关SO2的性质,下列说法不正确的是( )
| A. | 能使品红溶液褪色 | B. | 能与NaOH溶液反应 | ||
| C. | 能与H2O反应生成H2SO4 | D. | 一定条件下能与O2反应生成SO3 |
13.下列说法正确的是( )
| A. | 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 热化学方程式各物质前的化学计量数只表示分子个数不代表物质的量 | |
| C. | 燃烧热或中和热是反应热的种类之一 | |
| D. | 对于H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl△H<0,断开1mol H-H键和1mol Cl-Cl键所吸收的总能量大于形成2mol H-Cl键所放出的能量 |
20.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4L H2含有的分子数为NA | |
| B. | 标准状况下,80g SO3的体积为22.4L | |
| C. | 18g H2O在标准状况下的体积是22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA |
5.单质硅是信息产业中重要的基础材料.通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度为450℃~500℃),四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置图:

相关信息如下:①四氯化硅遇水极易水解
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物
③有关物质的物理常数见下表:
请回答下列问题:(1)写出装置A中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.装置C中的试剂是浓硫酸.
(2)装置A中g管的作用是平衡压强,使液体顺利流出并防止漏气;
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是Al、P(填写元素符号).
(4)甲方案:f接装置Ⅰ;乙方案:f接装置Ⅱ.但是装置Ⅰ、Ⅱ都有不足之处,请你设计一个合理方案并用文字表达:在装置Ⅰ的i处接干燥管j
(5)为了分析残留物中铁元素的含量,先将残留物预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO${\;}_{4}^{-}$+8H+=5Fe3++Mn2++4H2O 某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol•L-1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是4.480%.(写出计算过程)

相关信息如下:①四氯化硅遇水极易水解
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物
③有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | -57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
(2)装置A中g管的作用是平衡压强,使液体顺利流出并防止漏气;
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是Al、P(填写元素符号).
(4)甲方案:f接装置Ⅰ;乙方案:f接装置Ⅱ.但是装置Ⅰ、Ⅱ都有不足之处,请你设计一个合理方案并用文字表达:在装置Ⅰ的i处接干燥管j
(5)为了分析残留物中铁元素的含量,先将残留物预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO${\;}_{4}^{-}$+8H+=5Fe3++Mn2++4H2O 某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol•L-1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是4.480%.(写出计算过程)
2. 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知: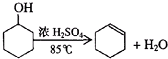
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝回流.
②试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填上或下),分液后用c (填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯蒸馏即可得到精品.
 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯已知:

| 密度(g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环已烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝回流.
②试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填上或下),分液后用c (填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯蒸馏即可得到精品.
3.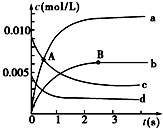 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)A点处,v(正)大于v(逆),A点正反应速率大于B点正反应速率(用“大于”、“小于”或“等于”填空).
(2)图中表示O2变化的曲线是d.用NO2表示从0~2s内该反应的平均速率v=3.0×10-3mol•L-1•s-1.
(3)能说明该反应已经达到平衡状态的是ad.
a.容器内压强保持不变 b.v(NO)=2v(O2)
c.容器内的密度保持不变d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是acd.
a.适当升高温度 b.及时分离出NO2气体c.增大O2的浓度 d.选择高效的催化剂.
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示O2变化的曲线是d.用NO2表示从0~2s内该反应的平均速率v=3.0×10-3mol•L-1•s-1.
(3)能说明该反应已经达到平衡状态的是ad.
a.容器内压强保持不变 b.v(NO)=2v(O2)
c.容器内的密度保持不变d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是acd.
a.适当升高温度 b.及时分离出NO2气体c.增大O2的浓度 d.选择高效的催化剂.