题目内容
15.在2L密闭容器中,把4molA和2molB混合,在一定条件下发生反应:3A(g)+2B(g)?4C(g)+2D(g),该反应达到化学平衡状态时,生成1.6molC,则此条件下A的平衡转化率为( )| A. | 10% | B. | 20% | C. | 30% | D. | 40% |
分析 由方程式可知△n(A):△n(C)=3:4,据此计算消耗A的物质的量,A的转化率=$\frac{反应的A的物质的量}{A的起始物质的量}$×100%.
解答 解:反应达到化学平衡状态时,生成1.6molC,由方程式可知,参加反应的A为1.6mol×$\frac{3}{4}$=1.2mol,故A的转化率为$\frac{1.2mol}{4mol}$×100%=30%,故选:C.
点评 本题考查化学平衡计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
5.单质硅是信息产业中重要的基础材料.通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度为450℃~500℃),四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置图:

相关信息如下:①四氯化硅遇水极易水解
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物
③有关物质的物理常数见下表:
请回答下列问题:(1)写出装置A中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.装置C中的试剂是浓硫酸.
(2)装置A中g管的作用是平衡压强,使液体顺利流出并防止漏气;
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是Al、P(填写元素符号).
(4)甲方案:f接装置Ⅰ;乙方案:f接装置Ⅱ.但是装置Ⅰ、Ⅱ都有不足之处,请你设计一个合理方案并用文字表达:在装置Ⅰ的i处接干燥管j
(5)为了分析残留物中铁元素的含量,先将残留物预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO${\;}_{4}^{-}$+8H+=5Fe3++Mn2++4H2O 某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol•L-1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是4.480%.(写出计算过程)

相关信息如下:①四氯化硅遇水极易水解
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物
③有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | -57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
(2)装置A中g管的作用是平衡压强,使液体顺利流出并防止漏气;
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是Al、P(填写元素符号).
(4)甲方案:f接装置Ⅰ;乙方案:f接装置Ⅱ.但是装置Ⅰ、Ⅱ都有不足之处,请你设计一个合理方案并用文字表达:在装置Ⅰ的i处接干燥管j
(5)为了分析残留物中铁元素的含量,先将残留物预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO${\;}_{4}^{-}$+8H+=5Fe3++Mn2++4H2O 某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol•L-1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是4.480%.(写出计算过程)
3.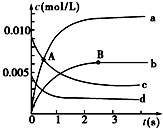 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)A点处,v(正)大于v(逆),A点正反应速率大于B点正反应速率(用“大于”、“小于”或“等于”填空).
(2)图中表示O2变化的曲线是d.用NO2表示从0~2s内该反应的平均速率v=3.0×10-3mol•L-1•s-1.
(3)能说明该反应已经达到平衡状态的是ad.
a.容器内压强保持不变 b.v(NO)=2v(O2)
c.容器内的密度保持不变d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是acd.
a.适当升高温度 b.及时分离出NO2气体c.增大O2的浓度 d.选择高效的催化剂.
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示O2变化的曲线是d.用NO2表示从0~2s内该反应的平均速率v=3.0×10-3mol•L-1•s-1.
(3)能说明该反应已经达到平衡状态的是ad.
a.容器内压强保持不变 b.v(NO)=2v(O2)
c.容器内的密度保持不变d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是acd.
a.适当升高温度 b.及时分离出NO2气体c.增大O2的浓度 d.选择高效的催化剂.
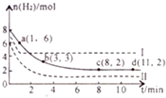 高效利用CO2是“低碳经济”的有效途径,现有以下两种利用CO2的方法.
高效利用CO2是“低碳经济”的有效途径,现有以下两种利用CO2的方法.