题目内容
【题目】配制一定物质的量浓度的MgSO4溶液时,下列情况可能导致实际浓度偏高的是( )
A.称量时部分MgSO4吸收了水蒸气
B.定容时俯视容量瓶上的刻度线
C.洗涤后的容量瓶中有少量水珠
D.溶解过程中有少量的溶液溅出烧杯外
【答案】B
【解析】
A.称量时部分MgSO4吸收了水蒸气,则溶质的质量减小,导致配制溶液浓度偏低,故A错误;
B.定容时俯视液面,会导致溶液体积骗小,则所配溶液浓度的影响偏高,故B正确;
C.洗涤后的容量瓶中有少量水珠,不影响溶液的体积和溶质的质量,对配制溶液的浓度无影响,故C错误;
D.溶解过程中有少量的溶液溅出烧杯外,则溶质的质量减小,导致配制溶液浓度偏低,故D错误;
故答案为B。

【题目】(Ⅰ)A、B、C为三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Na+、K+、Cu2+ |
阴离子 | SO42-、OH- |
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了32g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示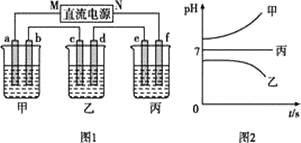
请回答下列问题:
(1)N为电源的(填“正”或“负”)极,电极b上发生的电极反应为。
(2)乙烧杯中的总反应为。
(3)计算电极e上生成的气体在标准状况下的体积为。
(4)丙烧杯要恢复到原来的状况,需要加入的物质和质量是。
(5)(Ⅱ)粗铜中一般含有锌、铁、银、金等杂质。在下图所示装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 接通电路一段时间后,精Cu电极质量增加了3.2g。在此过程中,甲池负极反应式 , 乙池硫酸铜溶液的浓度(填“变大”,“ 不变”,“变小”)。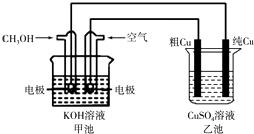
【题目】中华文化源远流长、博大精深。从化学的视角看,下列理解不正确的是
A | B | C | D |
千淘万漉虽辛苦,吹尽黄沙始到金。刘禹锡《浪淘沙》诗句 |
司母戊鼎 |
侯德榜 |
瓷器(China) |
诗句中“淘”“漉”相当于分离提纯操作中的“过滤”。 | 属青铜制品,是我国古代科技光辉成就的代表之一。 | 我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是烧碱。 | 属硅酸盐产品,China一词又指“瓷器”,这反映了在西方人眼中中国作为“瓷器故乡”的形象。 |
A. A B. B C. C D. D